ที่ถึง DNA igg ดั้งเดิม การวินิจฉัยทางห้องปฏิบัติการของโรคแพ้ภูมิตัวเอง
แอนติบอดีต่อ DNA สายคู่หรือแอนติบอดีต่อต้าน dsDNA เป็นกลุ่มของแอนติบอดีที่ต่างกันต่อ DNA สายคู่ ซึ่งเป็นเครื่องหมายในห้องปฏิบัติการ
แอนติบอดีต่อต้าน dsDNA คือ
autoantibodies ต่อ DNA ที่อยู่ภายในนิวเคลียส ไม่ทราบสาเหตุที่แน่ชัดสำหรับการปรากฏตัวของพวกเขา
ในบางกรณี การตอบสนองทางภูมิคุ้มกันไม่ได้มุ่งเป้าไปที่เซลล์แปลกปลอม แต่มุ่งเป้าไปที่เซลล์และเนื้อเยื่อของตัวเอง ในกรณีนี้พวกเขาพูดถึงการพัฒนาของโรคแพ้ภูมิตัวเอง และแอนติบอดีที่ผลิตต่อเซลล์ของตัวเองหรือส่วนประกอบต่างๆ เรียกว่าภูมิต้านตนเอง
ในกรณีที่ระบบภูมิคุ้มกันบกพร่องอย่างรุนแรง ระดับของออโตแอนติบอดีจะเพิ่มขึ้นและเพียงพอที่จะทำการวินิจฉัยได้
แอนติบอดีต่อ DNA ที่มีเกลียวคู่ไม่ใช่แอนติบอดีตัวเดียว แต่เป็นแอนติบอดีที่ซับซ้อนทั้งหมด เป้าหมายคือ DNA จากนิวเคลียสของเซลล์
ทดสอบแอนติบอดีต่อ DNA แบบเกลียวคู่มีความไวสูงต่อการวินิจฉัย เช่น ผลลัพธ์ที่เป็นบวกยืนยันการวินิจฉัย ตรวจพบแอนติบอดีต่อ dsDNA ในผู้ป่วย 70-80% แต่การขาดความละเอียดอ่อนของการศึกษาต้องใช้ความระมัดระวังในการอ่านผลการทดสอบ (เช่น ผลลบไม่รวมถึงการวินิจฉัยโรคลูปัส erythematosus แบบเป็นระบบ)
โรคลูปัส erythematosus ระบบ
Systemic lupus erythematosus เป็นโรคภูมิต้านตนเองที่รุนแรงซึ่งส่งผลกระทบต่ออวัยวะและระบบต่างๆ เช่น ผิวหนัง ข้อต่อ หัวใจ หลอดเลือด ไต และสมอง ไม่จำเป็นต้องมีอาการจากอวัยวะเหล่านี้พร้อมกัน โรคลูปัสมีอาการที่แปรปรวนมาก ในผู้ป่วยรายหนึ่ง อาการทางไตอาจมีอิทธิพลเหนือกว่า ในขณะที่ผู้ป่วยรายอื่นมีอาการทางผิวหนังมากกว่า
ปัจจัยเสี่ยง
- ความบกพร่องทางพันธุกรรม - ตามที่ยืนยันโดยการปรากฏตัวของญาติของผู้ป่วยที่เป็นโรคลูปัส erythematosus ระบบ ระดับต่ำ autoantibodies และแอนติเจน HLA บางชนิด
- การติดเชื้อไวรัส - กระตุ้นกระบวนการแพ้ภูมิตัวเอง
- - รังสีอัลตราไวโอเลต ทำให้เกิดการตายของเซลล์ผิวหนัง “เผย” DNA และทำให้มองเห็นได้ ระบบภูมิคุ้มกัน
- ยา - procainamide, hydralazine, methyldopa
- การเปลี่ยนแปลงของฮอร์โมน (,) ที่เกิดจากเอสโตรเจนและซึ่งอธิบายอุบัติการณ์ของโรคในสตรีสูง (90%)
อาการ
- อาการทั่วไป - อ่อนแรงและเหนื่อยล้า, ปวดกล้ามเนื้อ, ข้อต่อ, น้ำหนักลด, อุณหภูมิร่างกายเพิ่มขึ้น, ต่อมน้ำเหลืองบวม
- โรคข้ออักเสบและปวดข้อ - การอักเสบและปวดข้อของมือ, เข่า, ข้อมือ, ในภาพเอ็กซ์เรย์รอบข้อต่อลดลง ความหนาแน่นของกระดูก(periarticular Osteoporosis) แต่ไม่มีการสึกกร่อน
- ผื่นผีเสื้อบนใบหน้า และผื่นชนิดอื่นๆ
- ความไวแสง - อาการแย่ลงหลังจากได้รับแสงแดด
- serositis - การอักเสบ เยื่อหุ้มเซรุ่มหัวใจ, ปอด (เยื่อหุ้มหัวใจอักเสบ, เยื่อหุ้มปอดอักเสบ)
- ความเสียหายของไต (โรคไตอักเสบลูปัส) - ลดการทำงานของไตและอาการทางห้องปฏิบัติการสามประการ
- โปรตีนในปัสสาวะ - สูญเสียโปรตีนในปัสสาวะมากกว่า 0.5 กรัม/วัน (100%)
- microhematuria - ในตะกอนปัสสาวะ (80%)
- (45-65%)
เซลล์เม็ดเลือดขาว (WBC) จำนวนมากไม่ค่อยปรากฏในปัสสาวะในกรณีที่ไม่มีการติดเชื้อทางเดินปัสสาวะ
- ความเสียหายของปอด - โรคปอดอักเสบเฉียบพลันของลูปัส - มีอาการไข้ ไอ และมีถุงลมแทรกซึมเป็นหย่อมๆ
- อาการทางระบบประสาทจิตเวช - จากภาวะซึมเศร้าไปจนถึง paroxysms ของ epileptiform ความบกพร่องทางสายตาและโรคจิต
- อาการบวมของตุ่ม เส้นประสาทตาและรอยโรคสำลีบนเรตินา

การตรวจหาแอนติบอดีต่อ DNA ที่มีเกลียวคู่ในเลือดของผู้ป่วยที่เป็นโรคลูปัส erythematosus จำเป็นต้องมีการตรวจสอบซ้ำหลังจากผ่านไป 1-3-6-12 เดือน ขึ้นอยู่กับความรุนแรงของโรค ผู้ป่วยเหล่านี้มีความเสี่ยงเพิ่มขึ้นในการเกิดโรคไตอักเสบลูปัส เนื่องจากสารเชิงซ้อนต่อต้าน dsDNA ภูมิคุ้มกันทำลายไต
ข้อบ่งชี้สำหรับการทดสอบแอนติบอดีต่อต้าน dsDNA
- หากสงสัยว่าเป็นโรคแพ้ภูมิตัวเองอย่างเป็นระบบ
- หากคุณมีอาการของโรคลูปัส erythematosus แบบเป็นระบบ
- การวินิจฉัยแยกโรคของโรคข้อ
- ติดตามการดำเนินโรคลูปัส erythematosus อย่างเป็นระบบ
- ทำนายการพัฒนาของโรคไตอักเสบลูปัส
- โดยมีผลการทดสอบแอนติบอดีต่อแอนติบอดีเป็นบวก
- หากสงสัยว่าเป็นโรคทางระบบโดยเฉพาะโรคลูปัส erythematosus
- โดยมีผลการทดสอบแอนติบอดีต่อแอนติบอดี แอนติบอดี ENA เป็นบวก
- เพื่อทำนายความสำเร็จของการรักษา
ตรวจอาการอะไรบ้าง?
- โรคข้ออักเสบ - การอักเสบของข้อต่อ, แสดงออกด้วยความเจ็บปวด, บวม, การเคลื่อนไหวบกพร่อง, ผิวหนังแดงและอุณหภูมิที่เพิ่มขึ้น
- หรือไม่ทราบที่มา
- โรคไตที่เกิดจากภูมิคุ้มกันหรือการเปลี่ยนแปลงผลลัพธ์ (,)
- - การทำลายเซลล์เม็ดเลือดแดงที่มีระดับเพิ่มขึ้น
- thrombocytopenia - จำนวนลดลง
- - ลดจำนวนเข้า
- อาการทางผิวหนัง - ผื่น, ผิวหนังหนาขึ้นโดยเฉพาะหลังโดนแสงแดดจัด
- กลุ่มอาการของ Raynaud - การเปลี่ยนสีของนิ้วเท้าและมือเป็นระยะ (สีน้ำเงินและสีแดง) โดยมีความไวและความเจ็บปวดบกพร่อง
- อาการทางระบบประสาทและจิตเวชผิดปรกติ
- อุณหภูมิร่างกายเพิ่มขึ้น, ความเหนื่อยล้า, การลดน้ำหนัก,
บรรทัดฐาน
โดยปกติแล้ว แอนติบอดีต่อ DNA สายคู่จะไม่ถูกตรวจพบในเลือด
มาตรฐานดิจิทัลขึ้นอยู่กับระบบทดสอบที่ใช้ ควรทำการทดสอบออโตแอนติบอดีในห้องปฏิบัติการเดียวกัน
การวิจัยเพิ่มเติม
- แอนติบอดีต่อต้าน Sm
- แอนติบอดีต่อต้าน nRNP
- แอนติบอดีต่อต้าน SCL-70
- แอนติบอดีต่อต้านฮิสโตน
- แอนติบอดีต่อต้านเซนโทรเมียร์
- แอนติบอดีต่อต้าน sp100

สาเหตุของการปรากฏตัวของแอนติบอดีต่อต้าน dsDNA
- systemic lupus erythematosus - ผลการทดสอบที่เป็นบวกเป็นเกณฑ์ในการวินิจฉัย
- โรคลูปัส erythematosus ระบบที่เกิดจากยา
- ชาร์ปซินโดรม (โรคผสม เนื้อเยื่อเกี่ยวพัน)
- โรคข้ออักเสบรูมาตอยด์- นำเสนอใน ในบางกรณี, หายตัวไปเป็นกรณี การรักษาที่ประสบความสำเร็จ- แอนติบอดี abti-dsDNA อาจปรากฏขึ้นหลังการรักษาด้วยยาต่อต้าน TNF-alpha (adalimumab, infliximab, etanercept) - ชั่วคราว; เกี่ยวข้องกับ ความเสี่ยงที่เพิ่มขึ้นการปรากฏตัวของโรคลูปัส
- anti-dsDNA เชิงบวก - เกณฑ์สำหรับการวินิจฉัยโรคลูปัส erythematosus ในระบบ
- anti-dsDNA เชิงลบ - ไม่ยืนยันว่าไม่มีโรค

3. ฉันเป็นโรคลูปัส erythematosus แบบเป็นระบบ แอนติบอดีต่อต้าน dsDNA จะหายไปจากเลือดของฉันโดยสิ้นเชิงหรือไม่
เลขที่ ระดับอาจเพิ่มขึ้นหรือลดลงขึ้นอยู่กับความสำเร็จของการรักษาและรูปแบบการดำเนินชีวิต ใน ปริมาณขั้นต่ำ anti-dsDNA จะอยู่ในเลือดระหว่างการบรรเทาอาการ และสูงสุดในช่วงอาการกำเริบ
4. ฉันได้รับการวินิจฉัยว่ามีแอนติบอดีต่อ DNA ที่มีเกลียวคู่ แต่ฉันรู้สึกดีมาก ไม่มีอาการของ systemic lupus erythematosus เป็นไปได้ไหม?
ใช่. สามารถตรวจพบ anti-dsDNA ได้เล็กน้อยในเลือด คนที่มีสุขภาพดี- แต่ปรากฏการณ์นี้เกิดขึ้นชั่วคราว แอนติบอดีจะแสดงโดยอิมมูโนโกลบูลิน M ที่มีความอยากต่ำ (ระดับความแรงของการเชื่อมต่อระหว่างแอนติเจนและแอนติบอดี) และไม่ใช่ IgG ที่มีความโลภสูง เช่นเดียวกับในโรคลูปัส erythematosus แบบเป็นระบบ
ข้อเท็จจริง
- ค้นพบในปี พ.ศ. 2500 ในขณะเดียวกันก็มีการพิสูจน์ความเกี่ยวข้องกับโรคลูปัส erythematosus แบบเป็นระบบ
- พร้อมด้วย ปัจจัยไขข้ออักเสบเป็นออโตแอนติบอดีที่มีการศึกษามากที่สุด
แอนติบอดีต่อ DNA ที่มีเกลียวคู่แก้ไขล่าสุดเมื่อ: 23 พฤศจิกายน 2017 โดย มาเรีย บอดีอัน
เลเวลอัพ:
แอนติบอดีต่อ IgGเพื่อทำลาย DNA (สายเดี่ยว) (anti-ss DNA IgG)
แอนติบอดีต่อ DNA พื้นเมือง (เกลียวคู่)
Anti-ds DNA IgG เป็นหนึ่งในแอนติบอดีต่อต้านนิวเคลียร์ การมีอยู่ของแอนติบอดีเหล่านี้มีความเฉพาะเจาะจงสูงสำหรับโรคลูปัส erythematosus (SLE) ซึ่งพบได้น้อยและมีความเข้มข้นต่ำกว่าในที่อื่น แพร่กระจายโรคเนื้อเยื่อเกี่ยวพันหรือโรค SLE ที่เกิดจากยา สันนิษฐานว่าแอนติบอดี Anti-ds DNA เกี่ยวข้องโดยตรงกับการเกิดโรคของการพัฒนาของหลอดเลือดอักเสบและโรคไตอักเสบลูปัส ระดับของแอนติบอดี Anti-ds DNA ในผู้ป่วย SLE มีความสัมพันธ์โดยตรงกับความเข้มข้นของสารเชิงซ้อนการไหลเวียนที่มี IgG (CEC) ซึ่งมีอยู่ใน เพิ่มความเข้มข้นในไตของไตในผู้ป่วยโรค SLE รุนแรง พยาธิวิทยาของไต- มีการแสดงให้เห็นว่า dsDNA มีความสามารถในการจับกับเยื่อหุ้มชั้นใต้ดินของไต ซึ่งสามารถทำให้เกิดการก่อตัวของภูมิคุ้มกันเชิงซ้อนในโกลเมอรูลีได้โดยตรง การสะสมของภูมิคุ้มกันเชิงซ้อนนำไปสู่การกระตุ้นการทำงานของส่วนประกอบเสริม (โดยการใช้ปริมาณสำรองของซีรั่ม) และการพัฒนาของการอักเสบและความเสียหายของเนื้อเยื่อ
ความจำเพาะในการวินิจฉัยของการทดสอบ Anti-ds DNA สำหรับ SLE (% ผลการทดสอบเชิงลบในกรณีที่ไม่มีโรค) คือ 98% ในประชากรของผู้บริจาคที่มีสุขภาพดี และ 87% ในประชากรผู้ป่วยที่มีโรคภูมิต้านตนเองอื่นๆ ความไวในการวินิจฉัยของการทดสอบ SLE (% ของผลการทดสอบเชิงบวกเมื่อมีโรค) คือ 85% การใช้การตรวจหา Anti-ds DNA และแอนติบอดีต่อต้านนิวเคลียร์แบบบูรณาการจะเพิ่มความไวในการวินิจฉัยของการตรวจทางห้องปฏิบัติการในกรณีที่สงสัยว่าเป็นโรคลูปัส erythematosus ปริมาณแนะนำให้ใช้แอนติบอดี Anti-ds DNA IgG (รายเดือน) เพื่อติดตามอาการ การพยากรณ์โรค และการควบคุมการรักษาในผู้ป่วย SLE ระดับของแอนติบอดี Anti-ds DNA ในผู้ป่วย SLE มีความสัมพันธ์กับความรุนแรงของไตอักเสบ ความเข้มข้นของแอนติบอดีแปรผันตามการเปลี่ยนแปลงในกิจกรรม SLE การเพิ่มขึ้นอย่างเห็นได้ชัดในระดับของแอนติบอดี Anti-ds DNA ในช่วงหลายสัปดาห์และการลดลงของระดับส่วนประกอบในกรณีส่วนใหญ่เป็นสาเหตุของการกำเริบทางคลินิก ทันทีที่เกิดการกำเริบของ glomerulonephritis ระดับของแอนติบอดีอาจลดลง
ตรวจไม่พบแอนติบอดี Anti-ds DNA ในผู้ป่วยบางรายที่เป็นโรค SLE ดังนั้นผลการทดสอบที่เป็นลบจึงไม่ได้หมายความว่าจะเป็นโรคนี้ได้เสมอไป ในกรณีที่แยกได้ (น้อยกว่า 2%) สามารถสังเกตแอนติบอดี Anti-ds DNA ที่มีความเข้มข้นต่ำในคนที่ไม่มีเลย อาการทางคลินิกโรคแพ้ภูมิตัวเอง
เลเวลอัพ: โรคลูปัส erythematosus ระบบ (SLE); โรคข้ออักเสบรูมาตอยด์; กลุ่มอาการของSjögren; โรคหนังแข็ง; โรคตับอักเสบเรื้อรังที่ใช้งานอยู่ โรคตับแข็งทางเดินน้ำดีของตับ; การติดเชื้อที่เกิดจาก ไวรัสเอพสเตน-บาร์และไซโตเมกาโลไวรัส
การตรวจหาแอนติบอดีเหล่านี้อาจเกี่ยวข้องด้วย มีความเสี่ยงสูงพยาธิวิทยาทางสูติกรรม(การแท้งบุตร การเสียชีวิตของทารกในครรภ์ ภาวะมีบุตรยากโดยไม่ทราบสาเหตุ)
งานแสดงให้เห็นว่าแอนติบอดีที่มีสัมพรรคภาพต่ำและสัมพรรคภาพสูงที่มีประจุบวก คลาสไอจีจีไปยัง DNA ดั้งเดิม (IgG-Ab ถึง nDNA) ของผู้บริจาคและผู้ป่วยที่เป็นโรค systemic lupus erythematosus (SLE) ในระยะที่กำเริบของโรคจะมีผลทางพันธุกรรมที่คล้ายคลึงกันต่อเซลล์เม็ดเลือดขาวของบุคคลที่มีสุขภาพดีในหลอดทดลอง แอนติบอดีต่อ DNA ของผู้ป่วย SLE ในระยะเฉียบพลันซึ่งมีฤทธิ์ไฮโดรไลซ์ของ DNA แสดงความเป็นพิษต่อพันธุกรรมที่เด่นชัดมากขึ้นในเซลล์เม็ดเลือดขาวที่เพาะเลี้ยง พบว่าสเปกตรัมของการย่อยของสารพันธุกรรมในซีรั่มเลือดของผู้ป่วยโรคข้ออักเสบรูมาตอยด์นั้นกว้างกว่าในสภาวะปกติและใน SLE และแสดงด้วยแอนติบอดี IgG ที่มีความสัมพันธ์กับ nDNA สูง บทความกล่าวถึง เหตุผลที่เป็นไปได้การสร้างแอนติบอดีทางพยาธิวิทยาของคลาส IgG ไปยัง nDNA และพวกมัน บทบาททางชีววิทยาในร่างกาย
แอนติบอดีต่อ DNA
เซลล์เม็ดเลือดขาว
โรคลูปัส erythematosus ระบบ
โรคข้ออักเสบรูมาตอยด์
ความเป็นพิษต่อพันธุกรรม
1 อัคเบโรวา เอ็น.ไอ. การเปรียบเทียบข้อมูล II การทดสอบนัยสำคัญแบบไม่อิงพารามิเตอร์: คู่มือระเบียบวิธี- - คาซาน: สำนักพิมพ์ KSU, 2547 - 50 น.
2. อานิซิมอฟ เอ.จี. การรักษาเซลล์ K562 ที่ซิงโครไนซ์ด้วย tetrafluoroaluminate ไม่ได้ปรับการเรืองแสงของ ethidium bromide และ 4,6-diamidino-2-phenylindole เมื่อจับกับ nucleoid DNA / A.G. อานิซิมอฟ, ไอ.เอ. Bolotnikov // Cytology - 1999. - ต. 41. - หมายเลข 8. - หน้า 680-684
3. Arleevskaya M.I. เครื่องหมายวินิจฉัยและการพยากรณ์โรคข้ออักเสบรูมาตอยด์จากมุมมองของนักพยาธิสรีรวิทยา / M.I. อาร์ลีฟสกายา, A.G. Gabdulkhakova, A. Tsibulkin. - คาซาน: เรือ, 2010. - 128 น.
4. เนฟโซโรวา ที.เอ. ต้นกำเนิดและบทบาททางชีวภาพของ autoantibodies ต่อ DNA / T.A. Nevzorova, V.G. ฤดูหนาว // นักวิทยาศาสตร์. แซบ คาซาน. ยกเลิก เซอร์ เป็นธรรมชาติ ศาสตร์. - 2549. - ต. 148. - หนังสือ. 3. - หน้า 35-52.
5. ซาบีร์ซยาโนวา เอ.ซี. อิทธิพลของแอนติบอดี IgG ต่อ DNA ดั้งเดิมต่อโมโนไซต์ของมนุษย์ ในหลอดทดลอง / A.Z. Sabirzyanova, T.A. Nevzorova // วิทยาศาสตร์ แซบ คาซาน. ยกเลิก เซอร์ เป็นธรรมชาติ ศาสตร์. - 2551. - ต. 150. - หนังสือ. 2. - หน้า 186-200.
6. อาร์โดน เอส.พี. การพัฒนาความเข้าใจทางวิทยาศาสตร์ของโรคลูปัส / S.P. อาร์โดน, D.S. Pisetsky // การวิจัยและบำบัดโรคข้ออักเสบ. - 2551. - ฉบับที่. 10. - หมายเลข 5. - ร. 218-225.
7. กาบิบอฟ เอ.จี. ตัวเร่งปฏิกิริยา autoantibodies ในภูมิต้านตนเองทางคลินิกและการแพทย์แผนปัจจุบัน // Autoimmun Rev. - 2549. - ฉบับที่. 5. - หมายเลข 5. - ร. 324-330.
8. Kubota T. การเพิ่มประสิทธิภาพของความแตกแยกออกซิเดชันของ DNA โดยตำแหน่งที่มีผลผูกพันของแอนติบอดี DNA ที่ต่อต้านเกลียวคู่สองตัว // J. Biol เคมี. - พ.ศ. 2539. - เล่มที่. 271. - ลำดับที่ 11. - หน้า 6555-6561.
9. Rivadeneyra-Espinoza L. แอนติบอดีต่อ DNA ต่อต้านเจ้าของภาษาที่เจาะเซลล์ทำให้เกิดการตายของเซลล์ผ่านทางทั้งการละเลยและเส้นทางที่ตั้งโปรแกรมไว้ / L. Rivadeneyra-Espinoza, A. Ruiz-Argüelles // J Autoimmun - 2549. - ฉบับที่. 26. - ลำดับที่ 1. - ร. 52-56.
10. Yang R. เซลล์ Th1 และ Th2 ของ murine แบบ autopreactive ฆ่าแมคโครฟาจที่ทำงานร่วมกันและกระตุ้น autoantibodies // Lupus - พ.ศ. 2544. - ฉบับที่. 10. - หน้า 539-541.
เซลล์เม็ดเลือดขาวเป็นเซลล์หลักของระบบภูมิคุ้มกันซึ่งให้ภูมิคุ้มกันทางร่างกายและควบคุมปฏิสัมพันธ์และการทำงานของเซลล์ที่ซับซ้อน สิ่งมีชีวิตหลายเซลล์ในระหว่างการตอบสนองของภูมิคุ้มกัน
การละเมิด กิจกรรมการทำงาน T- และ B-lymphocytes สะท้อนให้เห็นในการพัฒนา รูปแบบต่างๆภูมิคุ้มกันบกพร่อง
Systemic lupus erythematosus (SLE) และโรคข้ออักเสบรูมาตอยด์ (RA) เป็นโรคแพ้ภูมิตนเองเรื้อรัง (AIDs) ด้วย สาเหตุที่ไม่ชัดเจนและภาพรวมของภูมิคุ้มกันโรคที่กว้างขวาง ลดคุณภาพและอายุขัยของประชากร จึงเป็นหนึ่งในชีวการแพทย์ที่สำคัญและ ปัญหาสังคมความทันสมัย
ผู้ป่วยโรค SLE มีลักษณะเฉพาะคือระดับ IgG แอนติบอดีต่อ nDNA เพิ่มขึ้นซึ่งมีฤทธิ์ไฮโดรไลซ์ DNA และอาจเกี่ยวข้องกับ กระบวนการทางพยาธิวิทยา- แต่ปัจจุบันไม่มีความเห็นพ้องต้องกันระหว่างนักวิจัยเกี่ยวกับการมีส่วนร่วมของแอนติบอดีต่อ nDNA ในการพัฒนาและหลักสูตร AIZ
ใน RA ยังมีระดับแอนติบอดีไฮโดรไลซ์ DNA เพิ่มขึ้นด้วย แต่อาการทางคลินิกแตกต่างจาก SLE ดังนั้นกระบวนการทางพยาธิวิทยาจึงสามารถกำหนดได้ไม่เพียงแต่โดยระดับของแอนติบอดีต่อ DNA เท่านั้น แต่ยังรวมถึงคุณสมบัติของพวกมันด้วย ซึ่งแตกต่างกันใน AIZ ต่างๆ
วิจัย ปีที่ผ่านมาแสดงให้เห็นว่าแอนติบอดีต่อ DNA บางชนิดเจาะเข้าไปในเซลล์และส่งผลต่อกระบวนการภายในเซลล์
อาจแนะนำได้ว่าแอนติบอดี IgG ต่อ nDNA ซึ่งมีปฏิสัมพันธ์กับ DNA ของเซลล์และการเปลี่ยนแปลงโครงสร้างโครมาตินทำให้เกิดการหยุดชะงักของการตายของเซลล์ภูมิคุ้มกันบกพร่องส่งผลให้วัสดุอะพอพโทติกเพิ่มขึ้นและเวลาในการไหลเวียนในกระแสเลือดซึ่งสังเกตได้ใน SLE และทำให้รุนแรงขึ้นในกระบวนการแพ้ภูมิตัวเอง
วัตถุประสงค์ของงานคือเพื่อศึกษาความเป็นพิษต่อพันธุกรรมของแอนติบอดี IgG ต่อ DNA ดั้งเดิมในการเพาะเลี้ยงเซลล์เม็ดเลือดขาวปฐมภูมิจากบุคคลที่มีสุขภาพดี
วัสดุและวิธีการวิจัย
การคัดเลือกIgG-Ab ถึง nDNA จากซีรั่มของมนุษย์
ทุกขั้นตอนของการทำให้บริสุทธิ์ของการแยกและการทำให้บริสุทธิ์ของ IgG-ABs ต่อ nDNA จากซีรั่มของผู้บริจาคและผู้ป่วยที่มี SLE และ RA ได้ดำเนินการตามวิธีการที่พัฒนาขึ้นก่อนหน้านี้ ในงานนี้ เราใช้แอนติบอดีต่อ DNA จากซีรั่มในเลือดของผู้หญิง - 20 ซีรั่มจากผู้บริจาคที่มีสุขภาพดี, 7 ซีรั่มจากผู้ป่วย SLE และ 20 ซีรั่มจากผู้ป่วยโรค RA ในระหว่างการกำเริบของโรค ซึ่งได้รับใน สถาบันการแพทย์คาซาน. การวินิจฉัยโรค SLE และ RA ทำโดยนักกายภาพบำบัดที่มีคุณสมบัติจากสถาบันการแพทย์แห่งรัฐคาซานของหน่วยงานกลางเพื่อการพัฒนาสุขภาพและสังคม .
การแยกลิมโฟไซต์ออกจากเลือดครบของบุคคลที่มีสุขภาพดีดำเนินการตาม วิธีการมาตรฐานบน ficoll-verographin - ความหนาแน่น 1.077 มก./มล.
การเพาะเลี้ยงลิมโฟไซต์ในบริเวณนั้นIgG-Ab ถึง nDNA
ไปยังเซลล์ (2.10 4 เซลล์/หลุม), เจือจาง สภาพแวดล้อมที่สมบูรณ์ RPMI-1640 pH 7.4 (Gibco, สกอตแลนด์), ประกอบด้วยเซรั่มวัวของทารกในครรภ์ที่ไม่ทำงาน 10%, กลูตามีน 2 มิลลิโมลาร์ (เซอร์วา, เยอรมนี), เพนิซิลลิน 100 ยูนิต/มล. (รัสเซีย), สเตรปโตมัยซิน 100 ไมโครกรัม/มล. (รัสเซีย), เศษส่วนย่อยที่บริสุทธิ์ของ IgG - Abs ถึง nDNA จนถึงความเข้มข้นสุดท้ายที่ 1 μg/ml การทดลองแต่ละครั้งทำซ้ำสามครั้ง เซลล์ถูกบ่มที่ 37 ºС, 0.5% CO 2 เป็นเวลา 72 ชั่วโมง
จำนวนเม็ดเลือดขาวทั้งหมดและมีชีวิตหลังจากแยกออกจากเลือดครบส่วนและการฟักตัวด้วยการย่อยของ IgG-Abs ถึง nDNA พวกมันถูกกำหนดโดยวิธีแยกทริแพนบลู
การกำหนดระดับความเสียหายต่อ DNA นิวเคลียร์ของเซลล์หลังจากการเพาะเลี้ยงด้วยการย่อยของ IgG-Abs ถึง nDNA แล้ว จะใช้ฟลูออเรสเซนซ์สเปกโตรโฟโตมิเตอร์เพื่อวัดการเปลี่ยนแปลงในความเข้มของฟลูออเรสเซนซ์ของคอมเพล็กซ์ EB-DNA ของลิมโฟไซต์โครมาติน
การกำหนดระดับความเสียหายของ DNA นิวเคลียร์โดยเจลอิเล็กโตรโฟรีซิสของเซลล์เดี่ยวที่ถูกสลาย - "DNA-ดาวหาง"
ใช้สารละลาย 1% ของอะกาโรสที่ละลายต่ำ (ถังหมัก แคนาดา) ใน PBS เจล agarose 60 ไมโครลิตรพร้อมเซลล์ (2.10 · 4 - 5.10 · 4) ถูกนำไปใช้กับสไลด์ที่เคลือบด้วยโพลีไลซีน (ApexLab, รัสเซีย) กระจายเท่า ๆ กันและทิ้งไว้ 30 นาทีที่ +20 °C การสลายเซลล์ (10 mM Tris-HCl pH 10, 2.5 โมลาร์ NaCl, 100 มิลลิโมลาร์ EDTA-Na2, 1% ไทรทัน X-100, 5% DMSO, +4 °C) ถูกดำเนินการเป็นเวลา 1 ชั่วโมง จากนั้นแก้วถูกถ่ายโอนไปยังบัฟเฟอร์อิเล็กโทรโฟเรซิส (NaOH 300 มิลลิโมลาร์, EDTA-Na2 1 มิลลิโมลาร์, pH>13, +4 °C) และทิ้งไว้ 20 นาที อิเล็กโทรโฟเรซิสดำเนินการเป็นเวลา 20 นาทีที่ 1 โวลต์/ซม. และ 300 mA เมื่อเสร็จสิ้น สารเตรียมจะถูกถ่ายโอนไปยังสารละลายสำหรับการตรึง (70% เอทานอล) เป็นเวลา 15 นาที หลังจากนั้นนำไปทำให้แห้งที่อุณหภูมิ +20 °C (1-2 ชั่วโมง) เซลล์ที่ถูกบ่มเป็นเวลา 5 นาทีที่ -20°C โดยมี 100 ไมโครโมลาร์ H2O2 ถูกใช้เป็นตัวควบคุมเชิงบวกสำหรับการแสดงภาพการเสื่อมสลายของ DNA สารเตรียมถูกย้อมด้วยสีส้มอะคริดีน (20 ไมโครกรัม/มิลลิลิตร) เป็นเวลา 30 นาที และวิเคราะห์ด้วยกล้องจุลทรรศน์ฟลูออเรสเซนซ์ (AxioScope A1, Carl Zeiss, เยอรมนี) ด้วยตัวกรองที่เหมาะสม (ตัวกรองการกระตุ้น 490 นาโนเมตร, กระจกไดโครอิก 510, ตัวกรองจุดตัด 530 นาโนเมตร) ) กำลังขยาย 40 เท่า
การประมวลผลข้อมูลเชิงสถิติ
จากข้อมูลที่ได้รับเกี่ยวกับการเปลี่ยนแปลงความมีชีวิตและความเข้มของแสงเรืองแสงของเซลล์ EB-DNA ค่ามัธยฐาน 97.5 และ 2.5 เปอร์เซ็นไทล์ถูกคำนวณโดยใช้แพ็คเกจมาตรฐาน โปรแกรมเอ็กเซล Office 2003 นอกจากนี้ยังใช้เกณฑ์ของ Dunnett ด้วย
ผลการวิจัยและการอภิปราย
การเพิ่มขึ้นของระดับแอนติบอดีต่อ DNA-hydrolyzing นั้นพบได้ใน SLE และ RA แต่ภาพทางคลินิกของโรคนั้นแตกต่างกัน สันนิษฐานว่าแอนติบอดี IgG ต่อ nDNA เป็นตัวเหนี่ยวนำและผู้เข้าร่วม กระบวนการอักเสบกับ AIZ แต่สิ่งที่กำหนดศักยภาพในการก่อโรคและวิธีการรับรู้ในร่างกายนั้นยังไม่เป็นที่เข้าใจอย่างถ่องแท้
ดังนั้นเพื่อความเข้าใจที่ลึกซึ้งยิ่งขึ้นเกี่ยวกับบทบาทของแอนติบอดีต่อ nDNA ในการเหนี่ยวนำและการลุกลาม โรคแพ้ภูมิตัวเองประเมินการพึ่งพาความเป็นพิษต่อพันธุกรรมของแอนติบอดี IgG ต่อ nDNA ในคุณสมบัติทางเคมีกายภาพและอิมมูโนเคมี
จากแต่ละซีรั่ม จะได้รับ IgG-Abs ที่ปราศจากสารเชิงซ้อนภูมิคุ้มกัน 4 ส่วนไปยัง nDNA ซึ่งประจุต่างกัน (เศษส่วน I มีลักษณะเป็นประจุบวกโดยรวม และเศษส่วน II ที่มีประจุลบโดยรวม) และความสัมพันธ์สำหรับ nDNA - เศษส่วนย่อย a ชะออกจากบัฟเฟอร์เซลลูโลส nDNA ที่มี NaCl 1 โมลาร์ และเศษส่วนย่อย b ซึ่งชะออกจากตัวดูดซับด้วยบัฟเฟอร์ Gly-HCl ที่มีค่า pH 2.3 ซึ่งช่วยให้เราสามารถสมมติความสัมพันธ์ที่มากขึ้นกับแอนติเจนได้
แสดงให้เห็นว่าเมื่อมี IgG-Abs ที่มีประจุบวกต่อผู้บริจาค nDNA จำนวนและจำนวนลิมโฟไซต์ที่มีชีวิตทั้งหมดจะลดลงเมื่อเปรียบเทียบกับกลุ่มควบคุม (PBS) (รูปที่ 1) IgG-ABs ต่อ nDNA ของผู้ป่วย SLE ในระยะที่กำเริบของโรคมีผลคล้ายกันกับเซลล์เม็ดเลือดขาวของบุคคลที่มีสุขภาพดีเช่นเดียวกับ AB จากผู้บริจาค แต่ผลของมันจะเด่นชัดกว่าซึ่งอาจเนื่องมาจากกิจกรรมการไฮโดรไลซ์ DNA สูง
ขาดผู้บริจาค อาการทางคลินิกโรคที่มีผลคล้ายกันต่อเซลล์ของ IgG-Abs ถึง nDNA ของผู้บริจาคและผู้ป่วยที่เป็นโรค SLE ในระยะที่กำเริบของโรคนั้นอธิบายได้จากข้อเท็จจริงที่ว่าระดับของ IgG-Abs ถึง nDNA ในเลือดของคนที่มีสุขภาพมีความสำคัญ ต่ำกว่าผู้ป่วยโรค SLE นอกจากนี้ แอนติบอดี IgG ส่วนใหญ่ต่อ nDNA ในเลือดของบุคคลที่มีสุขภาพดีนั้นเป็นส่วนหนึ่งของภูมิคุ้มกันเชิงซ้อนที่มีแอนติบอดีต่อต้านลักษณะเฉพาะหรือไบโอโพลีเมอร์ที่มีประจุลบซึ่งมีโครงสร้างคล้ายกับ DNA
ในกระบวนการแยก IgG-ABs เป็น nDNA จากซีรั่ม คอมเพล็กซ์ภูมิคุ้มกันของ AT-DNA จะถูกทำลายด้วยการก่อตัวของ Abs อิสระเป็น nDNA และในการทดลองกับเซลล์เม็ดเลือดขาวเราใช้ความเข้มข้นเท่ากันของ Abs ที่ทดสอบทั้งหมด ดังนั้นจึงได้รับโอกาสในการสังเกต ศักยภาพ ผลเสียบนเซลล์ ในหลอดทดลองที่ผู้บริจาค
ข้าว. 1. การเปลี่ยนแปลง จำนวนทั้งหมดและจำนวนลิมโฟไซต์ที่มีชีวิตของบุคคลที่มีสุขภาพดีหลังจากการฟักตัวเป็นเวลา 72 ชั่วโมงที่อุณหภูมิ 37 °C โดยมีเศษส่วนย่อย ไอจีจี-AT ถึง nDNA:
Ia - แอนติบอดี IgG ที่มีประจุบวกที่มีประจุบวกต่ำต่อ nDNA;
IIa - แอนติบอดี IgG ที่มีประจุลบที่มีประจุลบต่อ nDNA;
Ib - IgG-ABs ที่มีความสัมพันธ์สูงที่มีประจุบวกกับ nDNA;
IIb - IgG-ABs ที่มีสัมพรรคภาพสูงที่มีประจุลบกับ nDNA
มีแนวโน้มว่า SLE Abs ทางพยาธิวิทยาไปจนถึง nDNA อาจเกิดจาก Abs ตามธรรมชาติที่ทำหน้าที่ ฟังก์ชั่นการป้องกันแต่คำถามเกี่ยวกับสาเหตุของการสลับที่ผิดปกติดังกล่าวยังคงเปิดอยู่
แสดงให้เห็นเป็นครั้งแรกว่าสเปกตรัมของการย่อยพิษต่อเซลล์ของ IgG-ABs ถึง nDNA ในซีรั่มเลือดของผู้ป่วย RA แตกต่างจากบรรทัดฐานและ SLE นอกเหนือจากแอนติบอดีที่มีสัมพรรคภาพต่ำที่มีประจุบวกต่อ DNA คุณลักษณะของผู้บริจาคและผู้ป่วยโรค SLE การแยกส่วนย่อยที่มีประจุบวกและประจุลบของ IgG-ABs ต่อ nDNA ของผู้ป่วยโรค RA ที่มีความสัมพันธ์เชิงบวกสูง ยังนำไปสู่การลดลงอย่างเห็นได้ชัดในการแพร่กระจายและจำนวนเซลล์เม็ดเลือดขาวที่มีชีวิต ของบุคคลที่มีสุขภาพดี ในหลอดทดลอง.
ศึกษาการเปลี่ยนแปลงของการควบแน่นของลิมโฟไซต์โครมาตินหลังจากการสัมผัสกับเศษส่วนย่อยของ IgG-Ab ต่อ nDNA ถูกศึกษาโดยฟลูออเรสเซนซ์สเปกโตรโฟโตมิเตอร์ การก่อตัวของการแตกตัวใน DNA นำไปสู่การย่อยสลายโครมาติน, การเพิ่มขึ้นของตำแหน่งการจับของ EB ด้วยกรดนิวคลีอิกและการเรืองแสงที่เพิ่มขึ้นของคอมเพล็กซ์ EB-DNA
นอกจากนี้ ความเป็นพิษต่อพันธุกรรมของแอนติบอดี IgG ต่อ nDNA ได้รับการประเมินโดยใช้วิธี "DNA comet" ในกรณีที่มีการแตกตัวของ DNA โครงสร้างโครงสร้างของโครมาตินจะหยุดชะงักและการสูญเสียซูเปอร์คอยล์ไป ซึ่งนำไปสู่การผ่อนคลายของโมเลกุล ในสนามไฟฟ้า วงรีแลกซ์และชิ้นส่วน DNA จะถูกดึงเข้าหาขั้วบวก ซึ่งทำให้วัตถุที่สังเกตได้ดูเหมือน "ดาวหาง" ความยาวและโครงสร้างของ “หางของดาวหาง” สามารถใช้เพื่อตัดสินระดับการสลายตัวของ DNA ของเซลล์ได้
การเพิ่มขึ้นของความเข้มของการเรืองแสงของคอมเพล็กซ์ EB-DNA ในตัวอย่างที่บ่มด้วยแอนติบอดี IgG ที่มีประจุบวกกับ nDNA (Ia, Ib) จากผู้บริจาคบ่งบอกถึงการเปลี่ยนแปลงในโครงสร้าง DNA ของเซลล์โครมาติน - การกำจัด supercoiling และ การศึกษาที่เป็นไปได้การแตกร้าว (ตารางที่ 1) ภาพไมโครกราฟทั่วไปของวัตถุหลังจากการฟักตัวของเซลล์ที่มี IgG-Abs ที่มีประจุบวกไปจนถึง nDNA เผยให้เห็นการก่อตัวของ "หางดาวหาง" (รูปที่ 2B) ซึ่งไม่ได้สังเกตพบในการควบคุมเชิงลบของ PBS (รูปที่ 2A) และเป็นภาพสะท้อนของ ความเป็นพิษต่อพันธุกรรมของ Abs ต่อ DNA มีแนวโน้มว่า Abs ที่จับกับ DNA จากผู้บริจาคจะเจาะเข้าไปในเซลล์ สามารถเข้าถึงนิวเคลียส จับกับ DNA และเปลี่ยนโครงสร้างของมัน ตัวอย่างเช่น มีการแสดงให้เห็นว่า ATs ในบริเวณที่มีผลผูกพันกับ DNA ช่วยเพิ่มการทำลายโดยอนุมูลไฮดรอกซิลอย่างมีนัยสำคัญ เป็นไปได้ว่า Abs ถึง nDNA มีส่วนช่วยในการทำลาย nDNA แบบออกซิเดชัน โดยเปลี่ยนโครงสร้างของมัน ทำให้พื้นที่จำกัดสามารถเข้าถึงอนุมูลไฮดรอกซิลได้
ตารางที่ 1- การเปลี่ยนแปลงระดับเรืองแสงของโครมาติน EB-DNA ของลิมโฟไซต์หลังการฟักตัว 72 ชั่วโมงที่อุณหภูมิ 37 °C โดยมีเศษส่วนย่อยไอจีจี-AT ถึง nDNA
|
ส่วนย่อย ไอจีจี-AT ถึง nDNA |
ความเข้มของแสงเรืองแสงของคอมเพล็กซ์ EB-DNA หน่วย/เซลล์ |
|||
|
ผู้บริจาค |
การควบคุม (FSB) |
|||
|
สัมพรรคภาพต่ำที่มีประจุบวก |
7.85 (6.75; 8.32) |
9.52 (9.27; 11.06) |
8.51 (8.40; 8.91) |
6.67 (5.75; 6.85) |
|
ความสัมพันธ์ต่ำที่มีประจุลบ |
5.56 (5.04; 6.80) |
6.95 (6.49; 7.12) |
5.98 (5.53; 6.19) |
|
|
ประจุบวกมีความสัมพันธ์สูง |
9.10 (8.94; 9.15) |
9.82 (9.25; 9.94) |
9.52 (9.24; 9.64) |
|
|
ความสัมพันธ์สูงที่มีประจุลบ |
6.40 (5.64; 7.07) |
6.64 (6.46; 7.67) |
7.60 (6.96; 9.33) |
|
ผลเสียต่อโครงสร้างโครมาติน DNA ของเซลล์เม็ดเลือดขาวที่มีประจุบวกกับ subfractions ของ IgG-ABs ถึง nDNA (Ia, Ib) ของผู้ป่วย SLE ในระยะที่กำเริบของโรคนั้นเด่นชัดกว่าเมื่อเปรียบเทียบกับแอนติบอดีของผู้บริจาคซึ่งสะท้อนให้เห็นใน เพิ่มขึ้นอย่างรวดเร็วการเรืองแสงของคอมเพล็กซ์ EB-DNA ภาพจุลภาคทั่วไปของ “ดาวหาง DNA” แสดงการก่อตัวของ “หางดาวหาง” ที่กระจายเป็นวงกว้าง (รูปที่ 2D) ซึ่งเป็นหลักฐาน ระดับสูงการย่อยสลาย DNA ของลิมโฟไซต์ภายใต้อิทธิพลของแอนติบอดีต่อ DNA ของผู้ป่วย SLE ความเป็นพิษต่อพันธุกรรมของ IgG-Abs ต่อ nDNA ของผู้ป่วย SLE ในระหว่างการกำเริบของโรคนั้นเทียบได้กับผลของไฮโดรเจนเปอร์ออกไซด์ที่ใช้ในการทดลองนี้เป็นการควบคุมเชิงบวก (รูปที่ 2B) เป็นไปได้ว่าเมื่อรวมกับการจับกับ DNA แล้ว SLE-AB ที่ทำปฏิกิริยาไฮโดรไลซ์ DNA ในเซลล์ซึ่งไปถึงนิวเคลียส ก็สามารถทำหน้าที่เป็นตัวเร่งปฏิกิริยาทางชีวภาพสำหรับการไฮโดรไลซิสของพันธะฟอสโฟไดสเตอร์ของ DNA และด้วยเหตุนี้จึงแสดงความเป็นพิษต่อพันธุกรรม
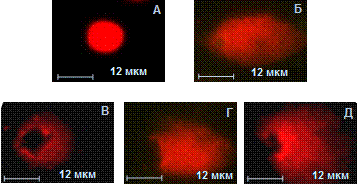
ข้าว. 2. ภาพถ่ายไมโครของ “ดาวหาง DNA” หลังจากการฟักตัวของเม็ดเลือดขาวลิมโฟไซต์ที่อุณหภูมิ 37°C เป็นเวลา 72 ชั่วโมง จากบุคคลที่มีสุขภาพดีซึ่งมี subfractionsไอจีจี-AT ถึง nDNA:
เอ - การควบคุมเชิงลบ(เอฟเอสบี); B - การควบคุมเชิงบวก (H 2 O 2);
B - ดาวหาง DNA ทั่วไปที่สังเกตได้หลังจากได้รับลิมโฟไซต์ถึง subfractions Ia และ Ib ของ IgG-AT ไปยังผู้บริจาค nDNA;
D - ดาวหาง DNA ทั่วไปที่สังเกตได้หลังจากได้รับลิมโฟไซต์ถึง subfractions Ia และ Ib ของ IgG-Abs ถึง nDNA ของผู้ป่วย SLE
D - ดาวหาง DNA ทั่วไปที่สังเกตได้หลังจากได้รับลิมโฟไซต์ถึง subfractions Ia, Ib และ IIb ของ IgG-Abs ถึง nDNA ของผู้ป่วย RA
จากผลลัพธ์ที่ได้รับ เราสามารถสรุปได้ว่าสำหรับผู้บริจาค Abs และ SLE-Abs เมื่อสัมผัสกับเซลล์ ในหลอดทดลอง มูลค่าที่สูงขึ้นมีค่าใช้จ่ายในโมเลกุล IgG-AT ต่อ nDNA แทนที่จะเป็นความสัมพันธ์กับแอนติเจน
พบว่าใน RA สเปกตรัมของการย่อยทางพันธุกรรมนั้นกว้างกว่าในสภาวะปกติและใน SLE - การเพิ่มขึ้นของการเรืองแสงของคอมเพล็กซ์ EB-DNA ของเซลล์โครมาตินจะถูกสังเกตหลังจากการฟักตัวของลิมโฟไซต์ที่มีประจุบวก subfractions ความสัมพันธ์ต่ำที่มีประจุบวก (Ia ) เช่นเดียวกับการย่อยความสัมพันธ์สูงของ IgG-Abs ต่อ nDNA ของผู้ป่วยที่เป็นโรค RA ในช่วงที่อาการกำเริบของโรคทั้งที่มีประจุบวกและลบ (Ib, IIb) เมื่อการย่อยของ IgG-Abs ถึง nDNA เหล่านี้ถูกสัมผัสกับเซลล์หลังจากอิเล็กโตรโฟรีซิส จะสังเกตเห็นการก่อตัวของ "หางดาวหาง" ที่กระจายในวงกว้าง (รูปที่ 2E) ซึ่งบ่งบอกถึงการก่อตัวของการแตกใน DNA ของลิมโฟไซต์ ซึ่งเป็นผลมาจาก ความเป็นพิษต่อพันธุกรรมสูงของ Abs ต่อ DNA ใน RA จากผลลัพธ์ที่ได้รับเราสามารถสรุปได้ว่าใน RA ศักยภาพในการทำให้เกิดโรคของแอนติบอดี IgG ต่อ nDNA ไม่ได้ถูกกำหนดโดยประจุของโมเลกุล แต่โดยความสัมพันธ์ของแอนติบอดีต่อแอนติเจน - DNA ดั้งเดิม สิ่งนี้ช่วยให้เราสามารถแนะนำลักษณะที่แตกต่างกันในตอนแรกของการก่อตัวของแอนติบอดี IgG ทางพยาธิวิทยาต่อ nDNA ใน RA
มีแนวโน้ม, เพิ่มขึ้นผิดปกติระดับเลือดของแอนติบอดีตามธรรมชาติต่อ DNA ใน เงื่อนไขบางประการสามารถนำไปสู่ความเสียหายต่อเซลล์ของระบบภูมิคุ้มกัน การเปลี่ยนแปลงกิจกรรมการทำงาน และการแสดงออกของยีน ซึ่งอาจส่งผลให้เกิดการละเมิดได้ สถานะภูมิคุ้มกันและการชักนำให้เกิดโรคภูมิต้านตนเองเนื่องจากการตายของเซลล์ที่รุนแรงขึ้น เซลล์ที่แข็งแรงและการสะสมของ B-lymphocytes ที่ถูกดัดแปลงซึ่งสร้าง IgG-ATs ทางพยาธิวิทยาเป็น nDNA ดังนั้น IgG-Abs ไปยัง nDNA จึงเป็นหนึ่งในการเชื่อมโยงที่สำคัญของระบบภูมิคุ้มกัน สะท้อนการเปลี่ยนแปลงในสถานะภูมิคุ้มกัน และมีส่วนร่วมในการรักษาสภาวะสมดุลในสิ่งมีชีวิตหลายเซลล์
ผู้วิจารณ์:
- Chikov V.I. วิทยาศาสตรดุษฎีบัณฑิต ศาสตราจารย์ สถาบัน สถาบันการศึกษารัสเซียสถาบันชีวเคมีและชีวฟิสิกส์คาซานวิทยาศาสตร์คาซาน ศูนย์วิทยาศาสตร์ราส, คาซาน.
- Gabdrakhmanova L.A. วิทยาศาสตรดุษฎีบัณฑิตสาขาวิทยาศาสตร์ชีวภาพ นักวิจัยอาวุโส หัวหน้าแผนกการศึกษาของสถาบันการศึกษางบประมาณของรัฐบาลกลางด้านการศึกษาวิชาชีพระดับสูง "มหาวิทยาลัยพลังงานแห่งรัฐคาซาน" คาซาน
รับงาน 10/03/2554
ลิงค์บรรณานุกรม
Sabirzyanova A.Z., Nevzorova T.A. แอนติบอดีต่อ DNA ในเลือดของผู้ป่วยที่มีโรคลูปัส erythematosus และโรคข้ออักเสบรูมาตอยด์แสดงความเป็นพิษต่อพันธุกรรมในวัฒนธรรมปฐมภูมิของลิมโฟไซต์ของบุคคลที่มีสุขภาพดี // ประเด็นร่วมสมัยวิทยาศาสตร์และการศึกษา – 2554. – ลำดับที่ 5.;URL: https://science-education.ru/ru/article/view?id=4811 (วันที่เข้าถึง: 22/12/2017) เรานำเสนอนิตยสารที่คุณจัดพิมพ์โดยสำนักพิมพ์ "Academy of Natural Sciences"
06.04.2015 13.10.2015
เมื่อการควบคุมระบบภูมิคุ้มกันถูกรบกวน ร่างกายจะเกิดการทำงานผิดปกติ การวินิจฉัยเบื้องต้นสภาพร่างกายเป็นสิ่งสำคัญ การระบุการเปลี่ยนแปลงของเลือดควรคำนึงถึงประเภทด้วย สิ่งแปลกปลอมและพลวัตของการเติบโตของพวกเขา พวกมันมุ่งเป้าไปที่ DNA แกนกลางของโมเลกุลจะเคลื่อนไปที่ขอบ และการศึกษาเหล่านี้กำลังดำเนินการเพื่อระบุโรค
การตรวจจับการเปลี่ยนแปลงของโมเลกุล
สามารถตรวจพบแอนติบอดีต่อ DNA ดั้งเดิมได้ วิธีการต่างๆความชุกก็คิดเป็นเปอร์เซ็นต์มาก พบในผู้ทุกข์ทรมานได้รับผลกระทบ โรคติดเชื้อ- บางครั้งอาจเกิดขึ้นได้ในคนที่มีสุขภาพดีเมื่อมองแวบแรก แต่ผู้ที่เป็นโรคทางพันธุกรรมมักจะพัฒนาในนั้น เมื่ออายุยังน้อย- นิวเคลียสของเซลล์ได้รับผลกระทบและเกิดกรดนิวคลีอิก หลังจากตรวจพบการเปลี่ยนแปลงโครงสร้างของโมเลกุลในคนที่มีสุขภาพดี โรคลูปัส erythematosus มักจะพัฒนาหลังจากผ่านไปห้าปี การเปลี่ยนแปลงกำลังเกิดขึ้น ผิวและการทำงานของไตบกพร่อง การตรวจพบในซีรัมมีความเกี่ยวข้องกับกิจกรรมของกระบวนการหรืออาจแนะนำการพยากรณ์โรคทางการแพทย์ ผลบวกได้รับการยืนยันจากข้อมูลการตรวจ
การกระทำ ยาเป็น ผลข้างเคียงโรคลูปัสที่เกิดจากยา กลุ่มอาการสามารถกระตุ้นได้ด้วยยาขณะรับประทานฟีนิโทอิน เช่น ยาควินิดีน คลอร์โปรมาซีน ไฮดราซีน การหยุดยาจะทำให้ระดับสิ่งแปลกปลอมลดลง ในช่วงหกเดือน การหายไปจากซีรั่มโดยสิ้นเชิง
เมื่อมีความล้มเหลวของระบบในร่างกาย แอนติบอดีจะถูกสร้างขึ้นโดยมีเป้าหมายที่ DNA แบบเกลียวคู่ตามธรรมชาติ ขณะเดียวกันระบบภูมิคุ้มกันก็แย่ลง การทำงานของไตและสมองก็แย่ลง มีอาการอักเสบและถูกทำลาย หลอดเลือด- ความเสียหายของหลอดเลือดเกี่ยวข้องโดยตรงกับความเสียหายของเนื้อเยื่อเกี่ยวพันที่หลีกเลี่ยงไม่ได้
การวิจัยระดับโมเลกุล
แอนติบอดีต่อ DNA ดั้งเดิมสามารถระบุได้โดยการวินิจฉัย SLE โดยจำเป็นต้องทำการทดสอบอิมมูโนซอร์เบนท์ที่เชื่อมโยงกับเอนไซม์ ซึ่งจะดำเนินการภายในหนึ่งวันทำการ การศึกษาใช้เวลา 2.5 ชั่วโมง ไม่จำเป็นต้องเตรียมตัวสำหรับการวิเคราะห์ โดยต้องรับประทานในขณะท้องว่าง ไม่มีข้อจำกัดด้านอาหารเป็นพิเศษ หลังจากเจาะเลือดด้วยเลือด เลือดจะถูกดูดเข้าไปในหลอดแก้ว การวิเคราะห์ดำเนินการด้วยซีรั่ม เลือดดำซึ่งบริสุทธิ์จากเปปไทด์และโปรตีน ทำการทดสอบอิมมูโนซอร์เบนท์ที่เชื่อมโยงกับเอนไซม์
ถ้าเป็นเซรั่ม เนื้อหาที่เพิ่มขึ้นการรวมจากต่างประเทศ สิ่งนี้บ่งบอกถึงโรคไตอักเสบลูปัส การทดสอบเชิงบวกเป็นพื้นฐานสำหรับการวินิจฉัยโรค SLE สิ่งสำคัญคือต้องระบุสิ่งแปลกปลอมที่บ่งบอกถึงการหยุดชะงักในการทำงานของ DNA เพื่อยืนยัน ผลลัพธ์ที่เป็นบวกอยู่ระหว่างดำเนินการศึกษาเพิ่มเติม การทดสอบแบบอนุกรมได้รับคำสั่งเพื่อประเมินการรักษา การตรวจนี้กำหนดโดยแพทย์ผิวหนัง นักไตวิทยา หรือแพทย์ผิวหนัง
ประเภทของการวินิจฉัย
นิวคลีโอโซมเกิดขึ้นจากการเชื่อมต่อระหว่างสาย DNA กับโปรตีนฮิสโตน และเป็นส่วนหนึ่งของโครโมโซม ตรวจพบนิวเคลียสในสภาวะบำบัดน้ำเสีย โรคมะเร็งและผู้ป่วยโรคเอสแอลอี ในระหว่างการตายของเซลล์ เอนโดนิวคลีสจะทำลาย DNA และนิวคลีโอโซมจะเข้าสู่ระบบไหลเวียนโลหิต
ผลการทดสอบที่เป็นบวกปรากฏอยู่ในผู้ป่วยส่วนใหญ่ที่เป็นโรคลูปัสและผู้ป่วยที่เป็นโรคไตอักเสบ พวกมันมีปฏิกิริยากับโปรตีนไซคลินซึ่งถูกทำลายหลังจากการแบ่งเซลล์ พบการเปลี่ยนแปลงใน 3% ของผู้ที่เป็นโรคลูปัส erythematosus ความจำเพาะของ PCNA autoantibodies สำหรับ SLE คือ 99% ผู้ที่เป็นโรคลูปัสจะแสดงความเสียหายต่อระบบประสาทส่วนกลางและภาวะเกล็ดเลือดต่ำ
แอนติบอดีอัตโนมัติต่อโปรตีนไรโบโซมมีความเฉพาะเจาะจงสูงสำหรับโรค SLE เกิดขึ้นในผู้ป่วยโรคตับอักเสบ มีความผิดปกติของระบบประสาทส่วนกลาง และในผู้ป่วยโรคจิต
แอนติบอดี Antiribonucleoprotein เป็นกลุ่มย่อยของ ANA และมักพบใน SLE 
ด้วยโรคที่ลุกลามมากขึ้นโรคลูปัสโรคจิตรอยโรคของระบบประสาทส่วนกลางเผยให้เห็นการมีอยู่ของแอนติบอดีต่อเอสเอ็ม ความชุกอยู่ระหว่าง 5 ถึง 40%
หนึ่งในสามของผู้ป่วยที่มีสัญญาณของเส้นโลหิตตีบหรือ polymyositis ก้าวหน้ามีแอนติบอดีต่อ U1-nRNP โรคนี้เรียกว่ากลุ่มอาการชาร์ป
ใน SLE นั้น autoantibodies ต่อ SS จะเกิดขึ้นพร้อมกับอาการที่รุนแรง อาการทางผิวหนัง- ผู้ป่วยดังกล่าวมีความไวแสงต่อรังสีอัลตราไวโอเลต สำหรับผู้ป่วย ระยะเวลาในการฟื้นตัวจากโรคเป็นเรื่องปกติ
ในการแพร่กระจายของ scleroderma จะพบแอนติบอดีต่อ topoisomerase การรวม Anticentromere จะไม่ปรากฏในคนที่มีสุขภาพแข็งแรง เมื่อตรวจพบแอนติบอดีดังกล่าว กลุ่มอาการของ Raynaud จะพัฒนาขึ้น
ผู้ป่วยที่มีแอนติบอดีต่อ PM-Scl ต้องการ ความสนใจเป็นพิเศษต่อการทำงานของปอด - พังผืดในปอดและถุงลมอักเสบเป็นเส้น ๆ Antimitochondrial antibodies M2 มีอยู่ในผู้ป่วยโรคตับแข็งน้ำดี
ในผู้ป่วยที่เป็นโรคหนังแข็ง โรคไขข้อมีแอนติบอดีต่อ Ro-52 อยู่
เมื่อพิจารณาจากประเภทของการวิจัย ประวัติความเป็นมาของโรคจะถูกสร้างขึ้นจากผลที่ได้รับ ความผิดปกติของระบบภูมิคุ้มกันส่งผลต่อรอยโรคทางผิวหนัง ระบบไหลเวียนโลหิต,เนื้อเยื่อเกี่ยวพัน ไต ข้อต่อ และอวัยวะอื่นๆ เศษส่วนของสารกันเลือดแข็งของ Lupus อาจทำให้เกิดการลุกลาม โรคเลือดออก- การปรากฏตัวของสิ่งแปลกปลอมในเลือดจะเปลี่ยนไปตามระยะของโรค ปริมาณมากบ่งบอกถึงโรคที่ก้าวหน้า แต่ลำดับนี้ไม่ได้เกิดขึ้นเสมอไป ระดับที่เพิ่มขึ้นลักษณะเฉพาะของโรคลูปัสที่เกิดจากยา การติดเชื้อไวรัสตับอักเสบบีและซี
ผลลัพธ์ได้รับอิทธิพลอย่างแข็งขัน การบำบัดที่มีประสิทธิภาพ, สูญเสียการควบคุมความก้าวหน้าของการรักษา สิ่งสำคัญคือต้องเน้นย้ำว่าการค้นหาผลลัพธ์ที่เป็นลบไม่ได้รับประกันว่าจะวินิจฉัยโรค SLE ได้ การตรวจหาอนุภาคขนาดเล็กแปลกปลอมโดยไม่มีการเปลี่ยนแปลงทางคลินิก ไม่ได้เป็นพื้นฐานในการวินิจฉัย มีความจำเป็นต้องใส่ใจกับสภาวะสุขภาพและทำการตรวจทางภูมิคุ้มกัน มีความผิดปกติมากมายในร่างกายที่ไม่แสดงออกมา แต่อย่างใดและบางครั้งก็กลายเป็นว่าสายเกินไปที่จะรักษา เพื่อรักษาสุขภาพจิตให้แข็งแรงและ ร่างกายแข็งแรงแพทย์แนะนำให้เข้ารับการตรวจสุขภาพประจำปี
แอนติบอดีต่อ DNA แบบเกลียวคู่ (anti-dsDNA), IgG
แอนติบอดี DNA ที่ต่อต้านเกลียวคู่นั้นเป็นแอนติบอดีอัตโนมัติที่มุ่งต่อต้าน DNA ที่มีเกลียวคู่ในตัว ซึ่งพบได้ใน systemic lupus erythematosus อยู่ระหว่างการศึกษาเพื่อวินิจฉัย ประเมินกิจกรรม และติดตามการรักษาโรคนี้
คำพ้องความหมายภาษารัสเซีย
แอนติบอดีต่อ DNA สายคู่, แอนติบอดีต่อ DNA ดั้งเดิม, แอนตี้ดีเอ็นเอ
คำพ้องความหมายภาษาอังกฤษ
แอนติบอดีต่อ ds-DNA, แอนติบอดี DNA แบบเกลียวคู่แบบเนทีฟ, แอนติบอดีต่อ ds-DNA, แอนติบอดี DNA แบบเกลียวคู่
วิธีการวิจัย
การทดสอบอิมมูโนซอร์เบนท์ที่เชื่อมโยงกับเอนไซม์ (ELISA)
หน่วยวัด
IU/ml (หน่วยสากลต่อมิลลิลิตร)
วัสดุชีวภาพชนิดใดที่สามารถนำไปใช้ในการวิจัยได้?
เลือดดำ
เตรียมตัวศึกษาวิจัยอย่างไรให้เหมาะสม?
ห้ามสูบบุหรี่เป็นเวลา 30 นาทีก่อนบริจาคเลือด
ข้อมูลทั่วไปเกี่ยวกับการศึกษา
แอนติบอดี DNA ต่อต้านเกลียวคู่ (anti-dsDNA) อยู่ในกลุ่มของแอนติบอดีต่อต้านนิวเคลียร์นั่นคือ autoantibodies ที่ควบคุมโดยร่างกายกับส่วนประกอบของนิวเคลียสของมันเอง ในขณะที่แอนติบอดีต่อต้านนิวเคลียร์เป็นลักษณะของโรคหลายชนิดในกลุ่ม แพร่กระจายโรคเนื้อเยื่อเกี่ยวพัน anti-dsDNA ถือเป็นลักษณะเฉพาะสำหรับ systemic lupus erythematosus (SLE) การตรวจหา anti-dsDNA เป็นหนึ่งในเกณฑ์ในการวินิจฉัย SLE
สามารถตรวจพบ Anti-dsDNA ได้โดยใช้เอนไซม์อิมมูโนแอสเสย์ ความไวสูง (ประมาณ 100%) ของการทดสอบนี้จำเป็นเมื่อทำการทดสอบตัวอย่างที่มีระดับแอนติบอดีต่ำ โดยพิจารณาว่าในเลือดของผู้ป่วย โรคทางระบบเนื้อเยื่อเกี่ยวพัน อาจมี autoantibodies หลายประเภทพร้อมกัน รวมถึงข้อเท็จจริงที่ว่าการวินิจฉัยแยกโรคของโรคเหล่านี้มักขึ้นอยู่กับการระบุโรคใด ๆ อย่างแม่นยำ บางประเภทแอนติบอดี การพิจารณาความจำเพาะสูงเป็นสิ่งสำคัญอย่างยิ่งเมื่อเลือกการทดสอบในห้องปฏิบัติการ ความจำเพาะของการทดสอบ anti-dsDNA คือ 99.2% ซึ่งทำให้การทดสอบนี้ขาดไม่ได้ในการวินิจฉัยแยกโรคของโรค SLE
Anti-dsDNA พบได้ในผู้ป่วย 50-70% ในขณะที่ได้รับการวินิจฉัย SLE เชื่อกันว่าคอมเพล็กซ์ภูมิคุ้มกันซึ่งประกอบด้วย DNA ที่มีเกลียวคู่และแอนติบอดีจำเพาะต่อมัน (อิมมูโนโกลบูลิน IgG และ IgM) มีส่วนร่วมในการพัฒนาของ microvasculitis และสาเหตุ อาการลักษณะ SLE ในรูปแบบของการทำลายผิวหนัง ไต ข้อต่อ และอวัยวะอื่นๆ อีกมากมาย Anti-dsDNA เป็นเรื่องปกติสำหรับ SLE ที่สามารถวินิจฉัยโรคนี้ได้แม้กระทั่งใน ผลลัพธ์เชิงลบการทดสอบคัดกรองสำหรับ อย่างไรก็ตาม ควรสังเกตว่าการไม่มี anti-dsDNA ไม่ได้ยกเว้นการมีอยู่ของ SLE
การตรวจหา anti-dsDNA ในผู้ป่วยที่ไม่มีอาการทางคลินิกและเกณฑ์อื่นๆ สำหรับโรคนี้ไม่ได้รับการตีความเพื่อสนับสนุนการวินิจฉัยโรค SLE แต่ผู้ป่วยดังกล่าวมีความเสี่ยงที่จะเป็นโรค SLE ในอนาคต และจำเป็นต้องได้รับการตรวจรักษาโดยแพทย์ด้านไขข้อ เนื่องจาก การปรากฏตัวของ anti-dsDNA อาจเกิดขึ้นก่อนการเจ็บป่วยเป็นเวลาหลายปี
ความเข้มข้นของ anti-dsDNA จะแตกต่างกันไปขึ้นอยู่กับลักษณะของโรค โดยปกติแล้ว คะแนนที่สูงจะบ่งบอกถึง กิจกรรมสูง SLE และต่ำ - เกี่ยวกับการบรรเทาอาการของโรค ดังนั้นการวัดความเข้มข้นของ anti-dsDNA จึงถูกนำมาใช้เพื่อติดตามการรักษาและการพยากรณ์โรค ความเข้มข้นที่เพิ่มขึ้นบ่งชี้ว่าการควบคุมโรคไม่เพียงพอการลุกลามของโรคตลอดจนความเป็นไปได้ในการเกิดโรคไตอักเสบลูปัส ในทางตรงกันข้าม ความเข้มข้นของแอนติบอดีที่ต่ำอย่างสม่ำเสมอถือเป็นสัญญาณบ่งชี้การพยากรณ์โรคที่ดี ควรสังเกตว่าการพึ่งพาอาศัยกันดังกล่าวไม่ได้สังเกตในทุกกรณี ระดับ Anti-dsDNA จะถูกวัดเป็นประจำ ทุก 3-6 เดือน ในกรณีดังกล่าว ระดับที่ไม่รุนแรงความรุนแรงของโรค SLE และในช่วงเวลาที่สั้นลงหากไม่มีการควบคุมโรค เมื่อเลือกการรักษา ระหว่างตั้งครรภ์หรือหลังคลอด
พิเศษ อาการทางคลินิกแสดงถึง โรคลูปัสที่เกิดจากยา- แม้จะมีความคล้ายคลึงกันอย่างมีนัยสำคัญ ภาพทางคลินิกภาวะของโรค SLE โรคลูปัสที่เกิดจากยานี้มีความแตกต่างหลายประการ: มันถูกกระตุ้นโดยการใช้ยา (procainamide, hydralazine, propylthiouracil, chlorpromazine, ลิเธียม ฯลฯ ) และหายไปอย่างสมบูรณ์หลังจากการถอนยา ไม่ค่อยเกี่ยวข้องกับ อวัยวะภายในและยังมีอีกมาก การพยากรณ์โรคที่ดีและยังมักไม่ค่อยรวมกับการมี anti-dsDNA อีกด้วย ดังนั้นหากผลการทดสอบ anti-dsDNA ให้ผลเป็นลบในผู้ป่วยที่มีอาการทางคลินิก โรคลูปัสแพ้ภูมิตัวเองและการมีอยู่ของปัจจัยต่อต้านนิวเคลียร์ควรไม่รวมโรคลูปัสที่เกิดจากยา
แม้ว่า anti-dsDNA ในระดับสูงจะเป็นลักษณะเฉพาะของโรค SLE แต่ความเข้มข้นต่ำของสารเหล่านี้ยังพบได้ในเลือดของผู้ป่วยที่มีโรคเนื้อเยื่อเกี่ยวพันชนิดแพร่กระจายอื่นๆ (กลุ่มอาการ Sjogren, โรคผสมเนื้อเยื่อเกี่ยวพัน) นอกจากนี้ การทดสอบอาจให้ผลบวกในผู้ป่วยโรคตับอักเสบบีและซีเรื้อรัง และการติดเชื้อโมโนนิวคลีโอซิส
สเปกตรัมของออโตแอนติบอดีใน SLE ยังรวมถึงแอนติบอดีต่อต้านนิวเคลียร์อื่นๆ (ต่อต้าน Sm, RNP, SS-A, SS-B), แอนติบอดีต่อต้านพลาสซึมและต่อต้านฟอสโฟไลปิด การตรวจหาเชื้อเหล่านี้ในเลือดของผู้ป่วยที่มีอาการทางคลินิกของโรค SLE ร่วมกับ anti-dsDNA ยังช่วยในการวินิจฉัยอีกด้วย นอกจากนี้ การตรวจวัดความเข้มข้นของสารต้าน dsDNA ควรเสริมด้วยการทดสอบทางคลินิกทั่วไปบางรายการ
ใช้วิจัยเพื่ออะไร?
- สำหรับการวินิจฉัย การประเมินกิจกรรม และการติดตามการรักษาโรคลูปัส erythematosus แบบเป็นระบบ
- สำหรับ การวินิจฉัยแยกโรคแพร่กระจายโรคเนื้อเยื่อเกี่ยวพัน
กำหนดการศึกษาเมื่อใด?
- สำหรับอาการของโรคลูปัส erythematosus แบบเป็นระบบ: ไข้, แผลที่ผิวหนัง (ผื่นแดงผีเสื้อหรือมีผื่นแดงบนใบหน้า, แขน, หน้าอก), ปวดข้อ/ข้ออักเสบ, ปอดอักเสบ, เยื่อหุ้มหัวใจอักเสบ, โรคลมบ้าหมู, ความเสียหายของไต;
- เมื่อตรวจพบแอนติบอดีต่อแอนติบอดีในซีรัมโดยเฉพาะอย่างยิ่งหากได้รับอิมมูโนฟลูออเรสเซนต์ชนิดเนื้อเดียวกันหรือเม็ด (จุด) ของนิวเคลียส
- เป็นประจำ ทุก 3-6 เดือน สำหรับโรค SLE ที่ไม่รุนแรง หรือบ่อยกว่านั้นหากควบคุมโรคไม่ได้
ผลลัพธ์หมายถึงอะไร?
ค่าอ้างอิง
ผลลัพธ์: ลบ
ความเข้มข้น: 0 - 25 IU/มล.
ผลลัพธ์ที่เป็นบวก:
- โรคลูปัส erythematosus ระบบ;
- การบำบัดที่มีประสิทธิภาพ, การบรรเทาอาการของโรคลูปัส erythematosus อย่างเป็นระบบ;
- กลุ่มอาการของSjögren;
- โรคเนื้อเยื่อเกี่ยวพันแบบผสม
- โรคตับอักเสบเรื้อรังบี และ ซี;
- โรคตับแข็งทางเดินน้ำดีปฐมภูมิ;
- mononucleosis ที่ติดเชื้อ
ผลลัพธ์เชิงลบ:
- ไม่มีโรคลูปัส erythematosus ที่เป็นระบบ;
- โรคลูปัสที่เกิดจากยา
อะไรสามารถมีอิทธิพลต่อผลลัพธ์?
- การบำบัดที่มีประสิทธิภาพและความสำเร็จของการบรรเทาอาการโรคนั้นสัมพันธ์กัน ประสิทธิภาพต่ำต่อต้าน dsDNA;
- ขาดการควบคุมโรคกำเริบของโรคโรคไตอักเสบลูปัสมีความเกี่ยวข้อง ประสิทธิภาพสูงต่อต้าน dsDNA
หมายเหตุสำคัญ
- การไม่มี anti-dsDNA ไม่ได้ยกเว้นการวินิจฉัยโรค SLE
- การตรวจหา anti-dsDNA ในผู้ป่วยที่ไม่มีอาการทางคลินิกและเกณฑ์อื่นๆ สำหรับโรคนี้ไม่ได้รับการตีความเพื่อสนับสนุนการวินิจฉัยโรค SLE
- Anti-dsDNA เป็นเครื่องหมายเฉพาะสำหรับ SLE แต่สามารถสังเกตได้ในโรคอื่นๆ บางชนิด (โรคตับอักเสบบีและซีเรื้อรัง โรคแพ้ภูมิตัวเอง)




