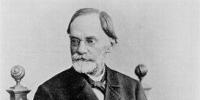O papel do mno2 na decomposição do peróxido de hidrogênio. Veja o que é “Peróxido de Hidrogênio” em outros dicionários
O conteúdo do artigo
PERÓXIDO DE HIDROGÊNIO– (nome antigo - peróxido de hidrogênio), um composto de hidrogênio e oxigênio H 2 O 2, contendo uma quantidade recorde de oxigênio - 94% em peso. Moléculas de H 2 O 2 contêm grupos peróxido –O–O– ( cm. PERÓXIDOS), que determinam em grande parte as propriedades deste composto.
O peróxido de hidrogênio foi obtido pela primeira vez em 1818 pelo químico francês Louis Jacques Thénard (1777 – 1857) tratando o peróxido de bário com ácido clorídrico altamente resfriado:
BaO 2 + 2HCl ® BaCl 2 + H 2 O 2 . O peróxido de bário, por sua vez, foi obtido pela queima do bário metálico. Para separar o H 2 O 2 da solução, Tenar removeu dela o cloreto de bário resultante: BaCl 2 + Ag 2 SO 4 ® 2AgCl + BaSO 4 . Para não utilizar no futuro um caro sal de prata, utilizou-se ácido sulfúrico para obter H 2 O 2: BaO 2 + H 2 SO 4 ® BaSO 4 + H 2 O 2, pois neste caso o sulfato de bário permanece no precipitado . Às vezes, outro método era usado: o dióxido de carbono era passado para uma suspensão de BaO 2 em água: BaO 2 + H 2 O + CO 2 ® BaCO 3 + H 2 O 2, uma vez que o carbonato de bário também é insolúvel. Este método foi proposto pelo químico francês Antoine Jerome Balard (1802-1876), que ficou famoso pela descoberta do novo elemento químico bromo (1826). Métodos mais exóticos também foram utilizados, por exemplo, a ação de uma descarga elétrica sobre uma mistura de 97% de oxigênio e 3% de hidrogênio à temperatura do ar líquido (cerca de –190 ° C), ou seja, uma solução de 87% de H 2 O 2 foi obtido.
O H 2 O 2 foi concentrado evaporando cuidadosamente soluções muito puras em banho-maria a uma temperatura não superior a 70–75 ° C; desta forma você pode obter uma solução de aproximadamente 50%. É impossível aquecer mais fortemente - ocorre a decomposição do H 2 O 2, então a destilação da água foi realizada a pressão reduzida, aproveitando a forte diferença na pressão de vapor (e, portanto, no ponto de ebulição) do H 2 O e H2O2. Então, a uma pressão de 15 mm Hg. Primeiro, principalmente a água é destilada e a 28 mm Hg. e uma temperatura de 69,7°C, o peróxido de hidrogênio puro é destilado. Outro método de concentração é o congelamento, pois quando soluções fracas congelam, o gelo quase não contém H 2 O 2. Finalmente, é possível desidratar absorvendo vapor de água com ácido sulfúrico no frio sob um sino de vidro.
Muitos pesquisadores do século 19 que obtiveram peróxido de hidrogênio puro notaram os perigos deste composto. Assim, quando tentaram separar o H 2 O 2 da água por extração de soluções diluídas com éter dietílico seguida de destilação do éter volátil, a substância resultante às vezes explodia sem motivo aparente. Em um desses experimentos, o químico alemão Yu. V. Bruhl obteve H 2 O 2 anidro, que tinha cheiro de ozônio e explodiu ao tocar uma barra de vidro não derretida. Apesar das pequenas quantidades de H 2 O 2 (apenas 1–2 ml), a explosão foi tão forte que abriu um buraco redondo no tampo da mesa, destruindo o conteúdo da gaveta, bem como os frascos e instrumentos que estavam sobre o mesa e nas proximidades.
Propriedades físicas.
O peróxido de hidrogênio puro é muito diferente da conhecida solução de H 2 O 2 a 3%, que está no armário de remédios caseiros. Em primeiro lugar, é quase uma vez e meia mais pesado que a água (a densidade a 20 ° C é de 1,45 g/cm 3). O H 2 O 2 congela a uma temperatura ligeiramente inferior ao ponto de congelamento da água - a menos 0,41 ° C, mas se você resfriar rapidamente um líquido puro, ele geralmente não congela, mas é super-resfriado, transformando-se em uma massa vítrea transparente. As soluções de H 2 O 2 congelam a uma temperatura significativamente mais baixa: uma solução a 30% - a menos 30 ° C, e uma solução a 60% - a menos 53 ° C. H 2 O 2 ferve a uma temperatura superior à da água comum, – a 150,2° C. O H 2 O 2 molha o vidro pior do que a água, e isso leva a um fenômeno interessante durante a destilação lenta de soluções aquosas: enquanto a água é destilada da solução, ela, como sempre, flui da geladeira para o receptor em forma de gotas; quando o H 2 O 2 começa a destilar, o líquido sai da geladeira na forma de um jato fino e contínuo. Na pele, o peróxido de hidrogênio puro e suas soluções concentradas deixam manchas brancas e causam sensação de queimação devido a queimadura química grave.
Em um artigo dedicado à produção de peróxido de hidrogênio, Tenard não comparou com muito sucesso essa substância com o xarope; talvez ele quisesse dizer que o H 2 O 2 puro, como o xarope de açúcar, refrata fortemente a luz. Na verdade, o índice de refração do H 2 O 2 anidro (1,41) é muito maior que o da água (1,33). No entanto, quer como resultado de má interpretação, quer devido a uma má tradução do francês, quase todos os livros didáticos ainda escrevem que o peróxido de hidrogénio puro é um “líquido espesso e xaroposo”, e até explicam isto teoricamente pela formação de ligações de hidrogénio. Mas a água também forma ligações de hidrogênio. Na verdade, a viscosidade do H 2 O 2 é a mesma da água ligeiramente resfriada (até cerca de 13 ° C), mas não se pode dizer que a água fria seja espessa como o xarope.
Reação de decomposição.
O peróxido de hidrogênio puro é uma substância muito perigosa, pois sob certas condições é possível sua decomposição explosiva: H 2 O 2 ® H 2 O + 1/2 O 2 com liberação de 98 kJ por mol de H 2 O 2 (34 g) . Esta é uma energia muito grande: é maior do que a liberada quando 1 mol de HCl é formado durante a explosão de uma mistura de hidrogênio e cloro; basta evaporar completamente 2,5 vezes mais água do que se forma nesta reação. Soluções aquosas concentradas de H 2 O 2 também são perigosas: na sua presença, muitos compostos orgânicos inflamam-se facilmente e tais misturas podem explodir com o impacto. Para armazenar soluções concentradas, utilize recipientes feitos de alumínio especialmente puro ou recipientes de vidro encerado.
Mais frequentemente você encontra uma solução menos concentrada de H 2 O 2 a 30%, chamada peridrol, mas essa solução também é perigosa: causa queimaduras na pele (quando exposta a ela, a pele fica imediatamente branca devido à descoloração de matéria corante); efervescência explosiva. A decomposição do H 2 O 2 e suas soluções, incluindo a decomposição explosiva, é causada por muitas substâncias, por exemplo, íons de metais pesados, que neste caso desempenham o papel de catalisador, e até mesmo partículas de poeira.
As explosões de H 2 O 2 são explicadas pela forte exotermicidade da reação, pela natureza em cadeia do processo e por uma diminuição significativa na energia de ativação da decomposição do H 2 O 2 na presença de várias substâncias, como pode ser julgado por os seguintes dados:
A enzima catalase é encontrada no sangue; É graças a ele que o “peróxido de hidrogênio” farmacêutico “ferve” a partir da liberação de oxigênio quando é usado para desinfetar um dedo cortado. A reação de decomposição de uma solução concentrada de H 2 O 2 sob a ação da catalase não é utilizada apenas por humanos; É essa reação que ajuda o besouro bombardeiro a lutar contra os inimigos, liberando um jato quente contra eles ( cm. EXPLOSIVOS). Outra enzima, a peroxidase, atua de forma diferente: não decompõe o H2O2, mas na sua presença ocorre a oxidação de outras substâncias com o peróxido de hidrogênio.
As enzimas que influenciam as reações do peróxido de hidrogênio desempenham um papel importante na vida da célula. A energia é fornecida ao corpo por reações de oxidação envolvendo oxigênio proveniente dos pulmões. Nessas reações, forma-se intermediáriamente o H 2 O 2, o que é prejudicial à célula, pois causa danos irreversíveis a diversas biomoléculas. Catalase e peroxidase trabalham juntas para converter H2O2 em água e oxigênio.
A reação de decomposição do H 2 O 2 freqüentemente ocorre de acordo com um mecanismo de cadeia radical ( cm. REAÇÕES EM CADEIA), enquanto o papel do catalisador é iniciar radicais livres. Assim, em uma mistura de soluções aquosas de H 2 O 2 e Fe 2+ (o chamado reagente de Fenton), ocorre uma reação de transferência de elétrons do íon Fe 2+ para a molécula de H 2 O 2 com a formação do Fe Íon 3+ e um ânion radical muito instável . –, que imediatamente se decompõe no ânion OH – e no radical hidroxila livre OH . (cm. RADICAIS LIVRES). Ele radical . muito ativo. Se houver compostos orgânicos no sistema, serão possíveis várias reações com radicais hidroxila. Assim, compostos aromáticos e hidroxiácidos são oxidados (o benzeno, por exemplo, se transforma em fenol), compostos insaturados podem anexar grupos hidroxila à ligação dupla: CH 2 = CH – CH 2 OH + 2 OH . ® HOCH 2 –CH(OH)–CH 2 –OH, e pode entrar em uma reação de polimerização. Na ausência de reagentes adequados, OH . reage com H 2 O 2 para formar um radical menos ativo HO 2 . , que é capaz de reduzir íons Fe 2+, que fecha o ciclo catalítico:
H 2 O 2 + Fe 2+ ® Fe 3+ + OH . +OH-
ELE . + H 2 O 2 ® H 2 O + HO 2 .
HO 2 . + Fe 3+ ® Fe 2+ + O 2 + H +
H + + OH – ® H 2 O.
Sob certas condições, é possível a decomposição em cadeia de H 2 O 2, cujo mecanismo simplificado pode ser representado pelo diagrama
ELE . + H 2 O 2 ® H 2 O + HO 2 . 2 . + H 2 O 2 ® H 2 O + O 2 + OH . etc.
As reações de decomposição do H 2 O 2 ocorrem na presença de vários metais de valência variável. Quando ligados a compostos complexos, muitas vezes aumentam significativamente a sua atividade. Por exemplo, os íons de cobre são menos ativos que os íons de ferro, mas ligados em complexos de amônia 2+, causam rápida decomposição de H 2 O 2. Os íons Mn 2+ ligados em complexos com alguns compostos orgânicos têm um efeito semelhante. Na presença desses íons foi possível medir o comprimento da cadeia de reação. Para fazer isso, primeiro medimos a taxa de reação pela taxa de liberação de oxigênio da solução. Em seguida, um inibidor foi introduzido na solução em concentração muito baixa (cerca de 10–5 mol/l), uma substância que reage efetivamente com os radicais livres e, assim, quebra a cadeia. A liberação de oxigênio parou imediatamente, mas após cerca de 10 minutos, quando todo o inibidor foi consumido, ela foi retomada novamente na mesma taxa. Conhecendo a taxa de reação e a taxa de terminação da cadeia, é fácil calcular o comprimento da cadeia, que acabou sendo igual a 10 3 unidades. O grande comprimento da cadeia determina a alta eficiência da decomposição do H 2 O 2 na presença dos catalisadores mais eficazes, que geram radicais livres em alta taxa. Num determinado comprimento de cadeia, a taxa de decomposição do H 2 O 2 na verdade aumenta mil vezes.
Às vezes, a decomposição perceptível do H 2 O 2 é causada até mesmo por vestígios de impurezas que são quase indetectáveis analiticamente. Assim, um dos catalisadores mais eficazes revelou-se um sol de ósmio metálico: o seu forte efeito catalítico foi observado mesmo numa diluição de 1:109, ou seja, 1 g Os por 1000 toneladas de água. Os catalisadores ativos são soluções coloidais de paládio, platina, irídio, ouro, prata, bem como óxidos sólidos de alguns metais - MnO 2, Co 2 O 3, PbO 2, etc., que por si só não mudam. A decomposição pode ocorrer muito rapidamente. Portanto, se uma pequena pitada de MnO 2 for jogada em um tubo de ensaio com uma solução de H 2 O 2 a 30%, uma coluna de vapor com um respingo de líquido escapará do tubo de ensaio. Com soluções mais concentradas ocorre uma explosão. A decomposição ocorre mais silenciosamente na superfície da platina. Neste caso, a taxa de reação é fortemente influenciada pelo estado da superfície. O químico alemão Walter Spring conduziu no final do século XIX. tal experiência. Em um copo de platina completamente limpo e polido, a reação de decomposição de uma solução de H 2 O 2 a 38% não ocorreu mesmo quando aquecida a 60 ° C. Se você fizer um arranhão quase imperceptível no fundo do copo com uma agulha, então, a solução já fria (a 12 ° C) começa a liberar bolhas de oxigênio no local do arranhão e, quando aquecida, a decomposição ao longo dessa área aumenta visivelmente. Se a platina esponjosa, que possui uma área superficial muito grande, for introduzida em tal solução, a decomposição explosiva será possível.
A rápida decomposição do H 2 O 2 pode ser usada para um experimento de palestra eficaz se um surfactante (sabão, xampu) for adicionado à solução antes de adicionar o catalisador. O oxigênio liberado cria uma rica espuma branca, que tem sido chamada de “pasta de dente de elefante”.
H 2 O 2 + 2I – + 2H + ® 2H 2 O + I 2
I 2 + H 2 O 2 ® 2I – + 2H + + O 2 .
Uma reação não em cadeia também ocorre no caso de oxidação de íons Fe 2+ em soluções ácidas: 2FeSO 4 + H 2 O 2 + H 2 SO 4 ® Fe 2 (SO 4) 3 + 2H 2 O.
Como as soluções aquosas quase sempre contêm vestígios de vários catalisadores (íons metálicos contidos no vidro também podem catalisar a decomposição), inibidores e estabilizadores que ligam íons metálicos são adicionados às soluções de H2O2, mesmo diluídas, durante o armazenamento a longo prazo. Nesse caso, as soluções ficam levemente acidificadas, pois a ação da água pura sobre o vidro produz uma solução levemente alcalina, que promove a decomposição do H 2 O 2.
Todas essas características da decomposição do H 2 O 2 permitem resolver a contradição. Para obter H 2 O 2 puro é necessário realizar destilação sob pressão reduzida, pois a substância se decompõe quando aquecida acima de 70 ° C e mesmo, embora muito lentamente, à temperatura ambiente (conforme indicado na Enciclopédia Química, a uma taxa de 0,5% ao ano). Neste caso, como foi obtido o ponto de ebulição à pressão atmosférica de 150,2° C, que aparece na mesma enciclopédia? Normalmente, nesses casos, uma lei físico-química é usada: o logaritmo da pressão de vapor de um líquido depende linearmente da temperatura inversa (na escala Kelvin), portanto, se você medir com precisão a pressão de vapor de H 2 O 2 em vários ( baixas), você pode calcular facilmente em que temperatura essa pressão atingirá 760 mm Hg. E este é o ponto de ebulição em condições normais.
Teoricamente, radicais OH . também pode se formar na ausência de iniciadores, como resultado da ruptura de uma ligação O-O mais fraca, mas isso requer uma temperatura bastante elevada. Apesar da energia relativamente baixa de quebra desta ligação na molécula de H 2 O 2 (é igual a 214 kJ/mol, que é 2,3 vezes menor do que para a ligação H – OH em uma molécula de água), a ligação O – O é ainda bastante forte, de modo que o peróxido de hidrogênio é absolutamente estável à temperatura ambiente. E mesmo no ponto de ebulição (150°C) deve decompor-se muito lentamente. Os cálculos mostram que nesta temperatura a decomposição de 0,5% também deve ocorrer de forma bastante lenta, mesmo que o comprimento da cadeia seja de 1000 elos. A discrepância entre os cálculos e os dados experimentais é explicada pela decomposição catalítica causada pelas menores impurezas no líquido e nas paredes do recipiente de reação. Portanto, a energia de ativação para a decomposição do H 2 O 2 medida por muitos autores é sempre significativamente inferior a 214 kJ/mol, mesmo “na ausência de um catalisador”. Na verdade, sempre existe um catalisador de decomposição - tanto na forma de impurezas insignificantes na solução quanto na forma das paredes do recipiente, razão pela qual o aquecimento do H 2 O 2 anidro até a ebulição à pressão atmosférica causou repetidamente explosões.
Sob algumas condições, a decomposição de H 2 O 2 ocorre de forma muito incomum, por exemplo, se você aquecer uma solução de H 2 O 2 acidificada com ácido sulfúrico na presença de iodato de potássio KIO 3, então em certas concentrações dos reagentes um oscilatório a reação é observada, e a liberação de oxigênio para periodicamente e depois recomeça com um período de 40 a 800 segundos.
Propriedades químicas do H2O2.
O peróxido de hidrogênio é um ácido, mas muito fraco. A constante de dissociação de H 2 O 2 H + + HO 2 – a 25° C é 2,4 · 10 –12, que é 5 ordens de grandeza menor do que para H 2 S. Sais médios H 2 O 2 de metais alcalinos e alcalino-terrosos são geralmente chamados de peróxidos ( cm. PERÓXIDOS). Quando dissolvidos em água, são quase completamente hidrolisados: Na 2 O 2 + 2H 2 O ® 2NaOH + H 2 O 2. A hidrólise é promovida pela acidificação das soluções. Como ácido, o H 2 O 2 também forma sais ácidos, por exemplo, Ba(HO 2) 2, NaHO 2, etc. Os sais ácidos são menos suscetíveis à hidrólise, mas se decompõem facilmente quando aquecidos, liberando oxigênio: 2NaHO 2 ® 2NaOH + Ó 2. O álcali liberado, como no caso do H 2 O 2, promove a decomposição.
Soluções de H 2 O 2, principalmente as concentradas, têm forte efeito oxidante. Assim, quando uma solução de H 2 O 2 a 65% é aplicada em papel, serragem e outras substâncias inflamáveis, elas inflamam. Soluções menos concentradas descoloram muitos compostos orgânicos, como o índigo. A oxidação do formaldeído ocorre de forma incomum: o H 2 O 2 é reduzido não a água (como de costume), mas a hidrogênio livre: 2HCHO + H 2 O 2 ® 2HCOOH + H 2 . Se você tomar uma solução de H 2 O 2 a 30% e uma solução de HCHO a 40%, depois de um pequeno aquecimento começa uma reação violenta, o líquido ferve e espuma. O efeito oxidativo de soluções diluídas de H 2 O 2 é mais pronunciado em ambiente ácido, por exemplo, H 2 O 2 + H 2 C 2 O 4 ® 2H 2 O + 2CO 2, mas a oxidação também é possível em ambiente alcalino :
Na + H 2 O 2 + NaOH® Na 2 ; 2K 3 + 3H 2 O 2 ® 2KCrO 4 + 2KOH + 8H 2 O.
A oxidação do sulfeto de chumbo preto em sulfato branco PbS + 4H 2 O 2 ® PbSO 4 + 4H 2 O pode ser usada para restaurar o chumbo branco escurecido em pinturas antigas. Sob a influência da luz, o ácido clorídrico também sofre oxidação:
H 2 O 2 + 2HCl ® 2H 2 O + Cl 2 . Adicionar H 2 O 2 a ácidos aumenta muito seu efeito sobre os metais. Assim, em uma mistura de H 2 O 2 e H 2 SO 4 diluído, cobre, prata e mercúrio se dissolvem; o iodo em um ambiente ácido é oxidado em ácido periódico HIO 3, o dióxido de enxofre em ácido sulfúrico, etc.
Excepcionalmente, a oxidação do sal de potássio e sódio do ácido tartárico (sal de Rochelle) ocorre na presença de cloreto de cobalto como catalisador. Durante a reação KOOC(CHOH) 2 COONa + 5H 2 O 2 ® KHCO 3 + NaHCO 3 + 6H 2 O + 2CO 2 CoCl 2 rosa muda de cor para verde devido à formação de um composto complexo com tartarato, o ânion do ácido tartárico. À medida que a reação prossegue e o tartarato é oxidado, o complexo é destruído e o catalisador fica rosa novamente. Se o sulfato de cobre for usado como catalisador em vez do cloreto de cobalto, o composto intermediário, dependendo da proporção dos reagentes iniciais, será de cor laranja ou verde. Após a conclusão da reação, a cor azul do sulfato de cobre é restaurada.
O peróxido de hidrogênio reage de maneira completamente diferente na presença de agentes oxidantes fortes, bem como de substâncias que liberam oxigênio facilmente. Nesses casos, o H 2 O 2 também pode atuar como agente redutor com liberação simultânea de oxigênio (a chamada decomposição redutiva do H 2 O 2), por exemplo:
2KMnO 4 + 5H 2 O 2 + 3H 2 SO 4 ® K 2 SO 4 + 2MnSO 4 + 5O 2 + 8H 2 O;
Ag 2 O + H 2 O 2 ® 2Ag + H 2 O + O 2 ;
O 3 + H 2 O 2 ® H 2 O + 2O 2 ;
NaOCl + H 2 O 2 ® NaCl + H 2 O + O 2 .
A última reação é interessante porque produz moléculas excitadas de oxigênio que emitem fluorescência laranja ( cm. CLORO ATIVO). Da mesma forma, o ouro metálico é liberado de soluções de sais de ouro, o mercúrio metálico é obtido a partir de óxido de mercúrio, etc. Esta propriedade incomum do H 2 O 2 permite, por exemplo, a oxidação do hexacianoferrato (II) de potássio e depois, alterando as condições, a redução do produto da reação ao composto original usando o mesmo reagente. A primeira reação ocorre em ambiente ácido, a segunda em ambiente alcalino:
2K 4 + H 2 O 2 + H 2 SO 4 ® 2K 3 + K 2 SO 4 + 2H 2 O;
2K 3 + H 2 O 2 + 2KOH ® 2K 4 + 2H 2 O + O 2 .
(“O duplo caráter” do H 2 O 2 permitiu que um professor de química comparasse o peróxido de hidrogênio com o herói da história do famoso escritor inglês Stevenson O estranho caso do Dr. Jekyll e do Sr. Hyde, sob a influência da composição que inventou, ele poderia mudar drasticamente seu caráter, passando de um cavalheiro respeitável a um maníaco sanguinário.)
Obtenção de H2O2.
As moléculas de H 2 O 2 são sempre obtidas em pequenas quantidades durante a combustão e oxidação de vários compostos. Durante a combustão, o H 2 O 2 é formado pela abstração de átomos de hidrogênio dos compostos iniciais por radicais hidroperóxidos intermediários, por exemplo: HO 2 . + CH 4 ® H 2 O 2 + CH 3 . , ou como resultado da recombinação de radicais livres ativos: 2OH . ® H 2 O 2 , Н . + MAS 2 . ® H 2 O 2 . Por exemplo, se uma chama de oxigênio-hidrogênio for direcionada a um pedaço de gelo, então a água derretida conterá quantidades perceptíveis de H 2 O 2 formado como resultado da recombinação de radicais livres (as moléculas de H 2 O 2 se desintegram imediatamente no chama). Um resultado semelhante é obtido quando outros gases queimam. A formação de H 2 O 2 também pode ocorrer em baixas temperaturas como resultado de vários processos redox.
Na indústria, o peróxido de hidrogênio não é mais produzido pelo método Tenara - a partir do peróxido de bário, mas são usados métodos mais modernos. Uma delas é a eletrólise de soluções de ácido sulfúrico. Neste caso, no ânodo, os íons sulfato são oxidados a íons persulfato: 2SO 4 2– – 2e ® S 2 O 8 2– . O ácido persulfúrico é então hidrolisado:
H 2 S 2 O 8 + 2H 2 O ® H 2 O 2 + 2H 2 SO 4 .
No cátodo, como de costume, o hidrogênio é liberado, então a reação geral é descrita pela equação 2H 2 O ® H 2 O 2 + H 2 . Mas o principal método moderno (mais de 80% da produção mundial) é a oxidação de alguns compostos orgânicos, por exemplo, a etilantrahidroquinona, com o oxigênio atmosférico em um solvente orgânico, enquanto o H 2 O 2 e a antraquinona correspondente são formados a partir da antrahidroquinona, que é em seguida, reduzido novamente com hidrogênio em um catalisador em antrahidroquinona. O peróxido de hidrogênio é removido da mistura com água e concentrado por destilação. Reação semelhante ocorre quando se utiliza álcool isopropílico (ocorre com a formação intermediária de hidroperóxido): (CH 3) 2 CHOH + O 2 ® (CH 3) 2 C(OOH)OH ® (CH 3) 2 CO + H 2 Ó 2. Se necessário, a acetona resultante também pode ser reduzida a álcool isopropílico.
Aplicação de H2O2.
O peróxido de hidrogênio é amplamente utilizado e sua produção global chega a centenas de milhares de toneladas por ano. É usado para produzir peróxidos inorgânicos, como oxidante para combustíveis de foguetes, em sínteses orgânicas, para branquear óleos, gorduras, tecidos, papel, para purificar materiais semicondutores, para extrair metais valiosos de minérios (por exemplo, urânio, convertendo sua forma insolúvel em solúvel), para tratamento de águas residuais. Na medicina, as soluções de H 2 O 2 são utilizadas para enxaguar e lubrificar em doenças inflamatórias das mucosas (estomatite, amigdalite) e no tratamento de feridas purulentas. Os estojos para lentes de contato às vezes têm uma quantidade muito pequena de catalisador de platina colocada na tampa. Para desinfetar as lentes, elas são colocadas em um estojo com uma solução de H 2 O 2 a 3%, mas como essa solução é prejudicial aos olhos, o estojo é virado depois de um tempo. Neste caso, o catalisador na tampa decompõe rapidamente o H 2 O 2 em água pura e oxigênio.
Já foi moda descolorir o cabelo com “peróxido”; agora existem compostos de coloração capilar mais seguros.
Na presença de certos sais, o peróxido de hidrogênio forma uma espécie de “concentrado” sólido, mais conveniente de transportar e usar. Assim, se H 2 O 2 for adicionado a uma solução saturada muito resfriada de borato de sódio (bórax), grandes cristais transparentes de peroxoborato de sódio Na 2 [(BO 2) 2 (OH) 4] se formam gradualmente. Essa substância é amplamente utilizada para branquear tecidos e como componente de detergentes. As moléculas de H 2 O 2, assim como as moléculas de água, são capazes de penetrar na estrutura cristalina dos sais, formando algo semelhante aos hidratos cristalinos - peroxohidratos, por exemplo, K 2 CO 3 · 3H 2 O 2, Na 2 CO 3 · 1,5H 20; o último composto é vulgarmente conhecido como "persol". A chamada “hidroperita” CO(NH 2) 2 ·H 2 O 2 é um clatrato - um composto de inclusão de moléculas de H 2 O 2 nos vazios da rede cristalina da ureia.
Na química analítica, o peróxido de hidrogênio pode ser usado para determinar alguns metais. Por exemplo, se o peróxido de hidrogênio for adicionado a uma solução de sal de titânio (IV), sulfato de titanila, a solução adquire uma cor laranja brilhante devido à formação de ácido pertitânico:
TiOSO 4 + H 2 SO 4 + H 2 O 2 ® H 2 + H 2 O. O íon molibdato incolor MoO 4 2– é oxidado por H 2 O 2 em um ânion peróxido intensamente laranja. Uma solução acidificada de dicromato de potássio na presença de H 2 O 2 forma ácido percrômico: K 2 Cr 2 O 7 + H 2 SO 4 + 5H 2 O 2 ® H 2 Cr 2 O 12 + K 2 SO 4 + 5H 2 O , que se decompõe rapidamente: H 2 Cr 2 O 12 + 3H 2 SO 4 ® Cr 2 (SO 4) 3 + 4H 2 O + 4O 2. Se somarmos essas duas equações, obtemos a reação de redução do dicromato de potássio com peróxido de hidrogênio:
K 2 Cr 2 O 7 + 4H 2 SO 4 + 5H 2 O 2 ® Cr 2 (SO 4) 3 + K 2 SO 4 + 9H 2 O + 4O 2.
O ácido percrômico pode ser extraído de uma solução aquosa com éter (é muito mais estável em solução de éter do que em água). A camada etérea fica de um azul intenso.
Ilya Leenson
PERÓXIDO DE HIDROGÊNIO– (nome antigo - peróxido de hidrogênio), um composto de hidrogênio e oxigênio H 2 O 2, contendo uma quantidade recorde de oxigênio - 94% em peso. Moléculas de H 2 O 2 contêm grupos peróxido –O–O– ( cm. PERÓXIDOS), que determinam em grande parte as propriedades deste composto.
O peróxido de hidrogênio foi obtido pela primeira vez em 1818 pelo químico francês Louis Jacques Thénard (1777 – 1857) tratando o peróxido de bário com ácido clorídrico altamente resfriado:
BaO 2 + 2HCl BaCl 2 + H 2 O 2. O peróxido de bário, por sua vez, foi obtido pela queima do bário metálico. Para separar o H 2 O 2 da solução, Tenar removeu dela o cloreto de bário resultante: BaCl 2 + Ag 2 SO 4 2AgCl + BaSO 4 . Para não usar no futuro um caro sal de prata, ácido sulfúrico foi usado para produzir H 2 O 2: BaO 2 + H 2 SO 4 BaSO 4 + H 2 O 2, pois neste caso o sulfato de bário permanece no precipitado . Às vezes, outro método era usado: o dióxido de carbono era passado para uma suspensão de BaO 2 em água: BaO 2 + H 2 O + CO 2 BaCO 3 + H 2 O 2, uma vez que o carbonato de bário também é insolúvel. Este método foi proposto pelo químico francês Antoine Jerome Balard (1802-1876), que ficou famoso pela descoberta do novo elemento químico bromo (1826). Métodos mais exóticos também foram utilizados, por exemplo, a ação de uma descarga elétrica sobre uma mistura de 97% de oxigênio e 3% de hidrogênio à temperatura do ar líquido (cerca de –190 ° C), ou seja, uma solução de 87% de H 2 O 2 foi obtido.
O H 2 O 2 foi concentrado evaporando cuidadosamente soluções muito puras em banho-maria a uma temperatura não superior a 70–75 ° C; desta forma você pode obter uma solução de aproximadamente 50%. É impossível aquecer mais fortemente - ocorre a decomposição do H 2 O 2, então a destilação da água foi realizada a pressão reduzida, aproveitando a forte diferença na pressão de vapor (e, portanto, no ponto de ebulição) do H 2 O e H2O2. Então, a uma pressão de 15 mm Hg. Primeiro, principalmente a água é destilada e a 28 mm Hg. e uma temperatura de 69,7°C, o peróxido de hidrogênio puro é destilado. Outro método de concentração é o congelamento, pois quando soluções fracas congelam, o gelo quase não contém H 2 O 2. Finalmente, é possível desidratar absorvendo vapor de água com ácido sulfúrico no frio sob um sino de vidro.
Muitos pesquisadores do século 19 que obtiveram peróxido de hidrogênio puro notaram os perigos deste composto. Assim, quando tentaram separar o H 2 O 2 da água por extração de soluções diluídas com éter dietílico seguida de destilação do éter volátil, a substância resultante às vezes explodia sem motivo aparente. Em um desses experimentos, o químico alemão Yu. V. Bruhl obteve H 2 O 2 anidro, que tinha cheiro de ozônio e explodiu ao tocar uma barra de vidro não derretida. Apesar das pequenas quantidades de H 2 O 2 (apenas 1–2 ml), a explosão foi tão forte que abriu um buraco redondo no tampo da mesa, destruindo o conteúdo da gaveta, bem como os frascos e instrumentos que estavam sobre o mesa e nas proximidades.
Propriedades físicas. O peróxido de hidrogênio puro é muito diferente da conhecida solução de H 2 O 2 a 3%, que está no armário de remédios caseiros. Em primeiro lugar, é quase uma vez e meia mais pesado que a água (a densidade a 20 ° C é de 1,45 g/cm 3). O H 2 O 2 congela a uma temperatura ligeiramente inferior ao ponto de congelamento da água - a menos 0,41 ° C, mas se você resfriar rapidamente um líquido puro, ele geralmente não congela, mas é super-resfriado, transformando-se em uma massa vítrea transparente. As soluções de H 2 O 2 congelam a uma temperatura significativamente mais baixa: uma solução a 30% - a menos 30 ° C, e uma solução a 60% - a menos 53 ° C. H 2 O 2 ferve a uma temperatura superior à da água comum, – a 150,2° C. O H 2 O 2 molha o vidro pior do que a água, e isso leva a um fenômeno interessante durante a destilação lenta de soluções aquosas: enquanto a água é destilada da solução, ela, como sempre, flui da geladeira para o receptor em forma de gotas; quando o H 2 O 2 começa a destilar, o líquido sai da geladeira na forma de um jato fino e contínuo. Na pele, o peróxido de hidrogênio puro e suas soluções concentradas deixam manchas brancas e causam sensação de queimação devido a queimadura química grave.
Em um artigo dedicado à produção de peróxido de hidrogênio, Tenard não comparou com muito sucesso essa substância com o xarope; talvez ele quisesse dizer que o H 2 O 2 puro, como o xarope de açúcar, refrata fortemente a luz. Na verdade, o índice de refração do H 2 O 2 anidro (1,41) é muito maior que o da água (1,33). No entanto, quer como resultado de má interpretação, quer devido a uma má tradução do francês, quase todos os livros didáticos ainda escrevem que o peróxido de hidrogénio puro é um “líquido espesso e xaroposo”, e até explicam isto teoricamente pela formação de ligações de hidrogénio. Mas a água também forma ligações de hidrogênio. Na verdade, a viscosidade do H 2 O 2 é a mesma da água ligeiramente resfriada (até cerca de 13 ° C), mas não se pode dizer que a água fria seja espessa como o xarope.
Reação de decomposição. O peróxido de hidrogênio puro é uma substância muito perigosa, pois sob certas condições é possível sua decomposição explosiva: H 2 O 2 H 2 O + 1/2 O 2 com liberação de 98 kJ por mol de H 2 O 2 (34 g) . Esta é uma energia muito grande: é maior do que a liberada quando 1 mol de HCl é formado durante a explosão de uma mistura de hidrogênio e cloro; basta evaporar completamente 2,5 vezes mais água do que se forma nesta reação. Soluções aquosas concentradas de H 2 O 2 também são perigosas: na sua presença, muitos compostos orgânicos inflamam-se facilmente e tais misturas podem explodir com o impacto. Para armazenar soluções concentradas, utilize recipientes feitos de alumínio especialmente puro ou recipientes de vidro encerado.
Mais frequentemente você encontra uma solução menos concentrada de H 2 O 2 a 30%, chamada peridrol, mas essa solução também é perigosa: causa queimaduras na pele (quando exposta a ela, a pele fica imediatamente branca devido à descoloração de matéria corante); efervescência explosiva. A decomposição do H 2 O 2 e suas soluções, incluindo a decomposição explosiva, é causada por muitas substâncias, por exemplo, íons de metais pesados, que neste caso desempenham o papel de catalisador, e até mesmo partículas de poeira.
As explosões de H 2 O 2 são explicadas pela forte exotermicidade da reação, pela natureza em cadeia do processo e por uma diminuição significativa na energia de ativação da decomposição do H 2 O 2 na presença de várias substâncias, como pode ser julgado por os seguintes dados:
A enzima catalase é encontrada no sangue; É graças a ele que o “peróxido de hidrogênio” farmacêutico “ferve” a partir da liberação de oxigênio quando é usado para desinfetar um dedo cortado. A reação de decomposição de uma solução concentrada de H 2 O 2 sob a ação da catalase não é utilizada apenas por humanos; É essa reação que ajuda o besouro bombardeiro a lutar contra os inimigos, liberando um jato quente contra eles ( cm. EXPLOSIVOS). Outra enzima, a peroxidase, atua de forma diferente: não decompõe o H2O2, mas na sua presença ocorre a oxidação de outras substâncias com o peróxido de hidrogênio.
As enzimas que influenciam as reações do peróxido de hidrogênio desempenham um papel importante na vida da célula. A energia é fornecida ao corpo por reações de oxidação envolvendo oxigênio proveniente dos pulmões. Nessas reações, forma-se intermediáriamente o H 2 O 2, o que é prejudicial à célula, pois causa danos irreversíveis a diversas biomoléculas. Catalase e peroxidase trabalham juntas para converter H2O2 em água e oxigênio.
A reação de decomposição do H 2 O 2 freqüentemente ocorre de acordo com um mecanismo de cadeia radical ( cm. REAÇÕES EM CADEIA), enquanto o papel do catalisador é iniciar radicais livres. Assim, em uma mistura de soluções aquosas de H 2 O 2 e Fe 2+ (o chamado reagente de Fenton), ocorre uma reação de transferência de elétrons do íon Fe 2+ para a molécula de H 2 O 2 com a formação do Fe Íon 3+ e um ânion radical muito instável . –, que imediatamente se decompõe no ânion OH – e no radical hidroxila livre OH . (cm. RADICAIS LIVRES). Ele radical . muito ativo. Se houver compostos orgânicos no sistema, serão possíveis várias reações com radicais hidroxila. Assim, compostos aromáticos e hidroxiácidos são oxidados (o benzeno, por exemplo, se transforma em fenol), compostos insaturados podem anexar grupos hidroxila à ligação dupla: CH 2 = CH – CH 2 OH + 2 OH . HOCH 2 –CH(OH)–CH 2 –OH, e pode entrar em uma reação de polimerização. Na ausência de reagentes adequados, OH . reage com H 2 O 2 para formar um radical menos ativo HO 2 . , que é capaz de reduzir íons Fe 2+, que fecha o ciclo catalítico:
H 2 O 2 + Fe 2+ Fe 3+ + OH . +OH-
ELE . + H 2 O 2 H 2 O + HO 2 .
HO 2 . + Fe 3+ Fe 2+ + O 2 + H +
H + + OH – H 2 O.
Sob certas condições, é possível a decomposição em cadeia de H 2 O 2, cujo mecanismo simplificado pode ser representado pelo diagrama
ELE . + H 2 O 2 H 2 O + HO 2 . 2 . + H 2 O 2 H 2 O + O 2 + OH . etc.
As reações de decomposição do H 2 O 2 ocorrem na presença de vários metais de valência variável. Quando ligados a compostos complexos, muitas vezes aumentam significativamente a sua atividade. Por exemplo, os íons de cobre são menos ativos que os íons de ferro, mas ligados em complexos de amônia 2+, causam rápida decomposição de H 2 O 2. Os íons Mn 2+ ligados em complexos com alguns compostos orgânicos têm um efeito semelhante. Na presença desses íons foi possível medir o comprimento da cadeia de reação. Para fazer isso, primeiro medimos a taxa de reação pela taxa de liberação de oxigênio da solução. Em seguida, um inibidor foi introduzido na solução em concentração muito baixa (cerca de 10–5 mol/l), uma substância que reage efetivamente com os radicais livres e, assim, quebra a cadeia. A liberação de oxigênio parou imediatamente, mas após cerca de 10 minutos, quando todo o inibidor foi consumido, ela foi retomada novamente na mesma taxa. Conhecendo a taxa de reação e a taxa de terminação da cadeia, é fácil calcular o comprimento da cadeia, que acabou sendo igual a 10 3 unidades. O grande comprimento da cadeia determina a alta eficiência da decomposição do H 2 O 2 na presença dos catalisadores mais eficazes, que geram radicais livres em alta taxa. Num determinado comprimento de cadeia, a taxa de decomposição do H 2 O 2 na verdade aumenta mil vezes.
Às vezes, a decomposição perceptível do H 2 O 2 é causada até mesmo por vestígios de impurezas que são quase indetectáveis analiticamente. Assim, um dos catalisadores mais eficazes revelou-se um sol de ósmio metálico: o seu forte efeito catalítico foi observado mesmo numa diluição de 1:109, ou seja, 1 g Os por 1000 toneladas de água. Os catalisadores ativos são soluções coloidais de paládio, platina, irídio, ouro, prata, bem como óxidos sólidos de alguns metais - MnO 2, Co 2 O 3, PbO 2, etc., que por si só não mudam. A decomposição pode ocorrer muito rapidamente. Portanto, se uma pequena pitada de MnO 2 for jogada em um tubo de ensaio com uma solução de H 2 O 2 a 30%, uma coluna de vapor com um respingo de líquido escapará do tubo de ensaio. Com soluções mais concentradas ocorre uma explosão. A decomposição ocorre mais silenciosamente na superfície da platina. Neste caso, a taxa de reação é fortemente influenciada pelo estado da superfície. O químico alemão Walter Spring conduziu no final do século XIX. tal experiência. Em um copo de platina completamente limpo e polido, a reação de decomposição de uma solução de H 2 O 2 a 38% não ocorreu mesmo quando aquecida a 60 ° C. Se você fizer um arranhão quase imperceptível no fundo do copo com uma agulha, então, a solução já fria (a 12 ° C) começa a liberar bolhas de oxigênio no local do arranhão e, quando aquecida, a decomposição ao longo dessa área aumenta visivelmente. Se a platina esponjosa, que possui uma área superficial muito grande, for introduzida em tal solução, a decomposição explosiva será possível.
A rápida decomposição do H 2 O 2 pode ser usada para um experimento de palestra eficaz se um surfactante (sabão, xampu) for adicionado à solução antes de adicionar o catalisador. O oxigênio liberado cria uma rica espuma branca, que tem sido chamada de “pasta de dente de elefante”.
H 2 O 2 + 2I – + 2H + 2H 2 O + I 2
I 2 + H 2 O 2 2I – + 2H + + O 2.
Uma reação não em cadeia também ocorre no caso de oxidação de íons Fe 2+ em soluções ácidas: 2FeSO 4 + H 2 O 2 + H 2 SO 4 Fe 2 (SO 4) 3 + 2H 2 O.
Como as soluções aquosas quase sempre contêm vestígios de vários catalisadores (íons metálicos contidos no vidro também podem catalisar a decomposição), inibidores e estabilizadores que ligam íons metálicos são adicionados às soluções de H2O2, mesmo diluídas, durante o armazenamento a longo prazo. Nesse caso, as soluções ficam levemente acidificadas, pois a ação da água pura sobre o vidro produz uma solução levemente alcalina, que promove a decomposição do H 2 O 2.
Todas essas características da decomposição do H 2 O 2 permitem resolver a contradição. Para obter H 2 O 2 puro é necessário realizar destilação sob pressão reduzida, pois a substância se decompõe quando aquecida acima de 70 ° C e mesmo, embora muito lentamente, à temperatura ambiente (conforme indicado na Enciclopédia Química, a uma taxa de 0,5% ao ano). Neste caso, como foi obtido o ponto de ebulição à pressão atmosférica de 150,2° C, que aparece na mesma enciclopédia? Normalmente, nesses casos, uma lei físico-química é usada: o logaritmo da pressão de vapor de um líquido depende linearmente da temperatura inversa (na escala Kelvin), portanto, se você medir com precisão a pressão de vapor de H 2 O 2 em vários ( baixas), você pode calcular facilmente em que temperatura essa pressão atingirá 760 mm Hg. E este é o ponto de ebulição em condições normais.
Teoricamente, radicais OH . também pode se formar na ausência de iniciadores, como resultado da ruptura de uma ligação O-O mais fraca, mas isso requer uma temperatura bastante elevada. Apesar da energia relativamente baixa de quebra desta ligação na molécula de H 2 O 2 (é igual a 214 kJ/mol, que é 2,3 vezes menor do que para a ligação H – OH em uma molécula de água), a ligação O – O é ainda bastante forte, de modo que o peróxido de hidrogênio é absolutamente estável à temperatura ambiente. E mesmo no ponto de ebulição (150°C) deve decompor-se muito lentamente. Os cálculos mostram que nesta temperatura a decomposição de 0,5% também deve ocorrer de forma bastante lenta, mesmo que o comprimento da cadeia seja de 1000 elos. A discrepância entre os cálculos e os dados experimentais é explicada pela decomposição catalítica causada pelas menores impurezas no líquido e nas paredes do recipiente de reação. Portanto, a energia de ativação para a decomposição do H 2 O 2 medida por muitos autores é sempre significativamente inferior a 214 kJ/mol, mesmo “na ausência de um catalisador”. Na verdade, sempre existe um catalisador de decomposição - tanto na forma de impurezas insignificantes na solução quanto na forma das paredes do recipiente, razão pela qual o aquecimento do H 2 O 2 anidro até a ebulição à pressão atmosférica causou repetidamente explosões.
Sob algumas condições, a decomposição de H 2 O 2 ocorre de forma muito incomum, por exemplo, se você aquecer uma solução de H 2 O 2 acidificada com ácido sulfúrico na presença de iodato de potássio KIO 3, então em certas concentrações dos reagentes um oscilatório a reação é observada, e a liberação de oxigênio para periodicamente e depois recomeça com um período de 40 a 800 segundos.
Propriedades químicas do H 2 SOBRE 2 . O peróxido de hidrogênio é um ácido, mas muito fraco. A constante de dissociação de H 2 O 2 H + + HO 2 – a 25° C é 2,4 · 10 –12, que é 5 ordens de grandeza menor do que para H 2 S. Sais médios H 2 O 2 de metais alcalinos e alcalino-terrosos são geralmente chamados de peróxidos ( cm. PERÓXIDOS). Quando dissolvidos em água, são quase completamente hidrolisados: Na 2 O 2 + 2H 2 O 2NaOH + H 2 O 2. A hidrólise é promovida pela acidificação das soluções. Como ácido, o H 2 O 2 também forma sais ácidos, por exemplo, Ba(HO 2) 2, NaHO 2, etc. Os sais ácidos são menos suscetíveis à hidrólise, mas se decompõem facilmente quando aquecidos, liberando oxigênio: 2NaHO 2 2NaOH + Ó 2. O álcali liberado, como no caso do H 2 O 2, promove a decomposição.
Soluções de H 2 O 2, principalmente as concentradas, têm forte efeito oxidante. Assim, quando uma solução de H 2 O 2 a 65% é aplicada em papel, serragem e outras substâncias inflamáveis, elas inflamam. Soluções menos concentradas descoloram muitos compostos orgânicos, como o índigo. A oxidação do formaldeído ocorre de forma incomum: H 2 O 2 é reduzido não a água (como de costume), mas a hidrogênio livre: 2HCHO + H 2 O 2 2HCOOH + H 2 . Se você tomar uma solução de H 2 O 2 a 30% e uma solução de HCHO a 40%, depois de um pequeno aquecimento começa uma reação violenta, o líquido ferve e espuma. O efeito oxidativo de soluções diluídas de H 2 O 2 é mais pronunciado em um ambiente ácido, por exemplo, H 2 O 2 + H 2 C 2 O 4 2H 2 O + 2CO 2, mas a oxidação também é possível em um ambiente alcalino :
Na + H 2 O 2 + NaOH Na 2; 2K 3 + 3H 2 O 2 2KCrO 4 + 2KOH + 8H 2 O.
A oxidação do sulfeto de chumbo preto em sulfato branco PbS + 4H 2 O 2 PbSO 4 + 4H 2 O pode ser usada para restaurar o branco de chumbo escurecido em pinturas antigas. Sob a influência da luz, o ácido clorídrico também sofre oxidação:
H 2 O 2 + 2HCl 2H 2 O + Cl 2. Adicionar H 2 O 2 a ácidos aumenta muito seu efeito sobre os metais. Assim, em uma mistura de H 2 O 2 e H 2 SO 4 diluído, cobre, prata e mercúrio se dissolvem; o iodo em um ambiente ácido é oxidado em ácido periódico HIO 3, o dióxido de enxofre em ácido sulfúrico, etc.
Excepcionalmente, a oxidação do sal de potássio e sódio do ácido tartárico (sal de Rochelle) ocorre na presença de cloreto de cobalto como catalisador. Durante a reação KOOC(CHOH) 2 COONa + 5H 2 O 2 KHCO 3 + NaHCO 3 + 6H 2 O + 2CO 2 CoCl 2 rosa muda de cor para verde devido à formação de um composto complexo com tartarato, o ânion do ácido tartárico. À medida que a reação prossegue e o tartarato é oxidado, o complexo é destruído e o catalisador fica rosa novamente. Se o sulfato de cobre for usado como catalisador em vez do cloreto de cobalto, o composto intermediário, dependendo da proporção dos reagentes iniciais, será de cor laranja ou verde. Após a conclusão da reação, a cor azul do sulfato de cobre é restaurada.
O peróxido de hidrogênio reage de maneira completamente diferente na presença de agentes oxidantes fortes, bem como de substâncias que liberam oxigênio facilmente. Nesses casos, o H 2 O 2 também pode atuar como agente redutor com liberação simultânea de oxigênio (a chamada decomposição redutiva do H 2 O 2), por exemplo:
2KMnO 4 + 5H 2 O 2 + 3H 2 SO 4 K 2 SO 4 + 2MnSO 4 + 5O 2 + 8H 2 O;
Ag 2 O + H 2 O 2 2Ag + H 2 O + O 2;
O 3 + H 2 O 2 H 2 O + 2O 2 ;
NaOCl + H 2 O 2 NaCl + H 2 O + O 2.
A última reação é interessante porque produz moléculas excitadas de oxigênio que emitem fluorescência laranja ( cm. CLORO ATIVO). Da mesma forma, o ouro metálico é liberado de soluções de sais de ouro, o mercúrio metálico é obtido a partir de óxido de mercúrio, etc. Esta propriedade incomum do H 2 O 2 permite, por exemplo, a oxidação do hexacianoferrato (II) de potássio e depois, alterando as condições, a redução do produto da reação ao composto original usando o mesmo reagente. A primeira reação ocorre em ambiente ácido, a segunda em ambiente alcalino:
2K 4 + H 2 O 2 + H 2 SO 4 2K 3 + K 2 SO 4 + 2H 2 O;
2K 3 + H 2 O 2 + 2KOH 2K 4 + 2H 2 O + O 2.
(“O duplo caráter” do H 2 O 2 permitiu que um professor de química comparasse o peróxido de hidrogênio com o herói da história do famoso escritor inglês Stevenson O estranho caso do Dr. Jekyll e do Sr. Hyde, sob a influência da composição que inventou, ele poderia mudar drasticamente seu caráter, passando de um cavalheiro respeitável a um maníaco sanguinário.)
Recebendo H 2 SOBRE 2 . As moléculas de H 2 O 2 são sempre obtidas em pequenas quantidades durante a combustão e oxidação de vários compostos. Durante a combustão, o H 2 O 2 é formado pela abstração de átomos de hidrogênio dos compostos iniciais por radicais hidroperóxidos intermediários, por exemplo: HO 2 . + CH 4 H 2 O 2 + CH 3 . , ou como resultado da recombinação de radicais livres ativos: 2OH . H 2 O 2, N . + MAS 2 . H 2 O 2 . Por exemplo, se uma chama de oxigênio-hidrogênio for direcionada a um pedaço de gelo, então a água derretida conterá quantidades perceptíveis de H 2 O 2 formado como resultado da recombinação de radicais livres (as moléculas de H 2 O 2 se desintegram imediatamente no chama). Um resultado semelhante é obtido quando outros gases queimam. A formação de H 2 O 2 também pode ocorrer em baixas temperaturas como resultado de vários processos redox.
Na indústria, o peróxido de hidrogênio não é mais produzido pelo método Tenara - a partir do peróxido de bário, mas são usados métodos mais modernos. Uma delas é a eletrólise de soluções de ácido sulfúrico. Neste caso, no ânodo, os íons sulfato são oxidados em íons supersulfato: 2SO 4 2– – 2e S 2 O 8 2– . O ácido persulfúrico é então hidrolisado:
H 2 S 2 O 8 + 2H 2 O H 2 O 2 + 2H 2 SO 4.
No cátodo, como sempre, o hidrogênio é liberado, então a reação geral é descrita pela equação 2H 2 O H 2 O 2 + H 2 . Mas o principal método moderno (mais de 80% da produção mundial) é a oxidação de alguns compostos orgânicos, por exemplo, a etilantrahidroquinona, com o oxigênio atmosférico em um solvente orgânico, enquanto o H 2 O 2 e a antraquinona correspondente são formados a partir da antrahidroquinona, que é em seguida, reduzido novamente com hidrogênio em um catalisador em antrahidroquinona. O peróxido de hidrogênio é removido da mistura com água e concentrado por destilação. Uma reação semelhante ocorre quando se utiliza álcool isopropílico (ocorre com a formação intermediária de hidroperóxido): (CH 3) 2 CHOH + O 2 (CH 3) 2 C(OOH)OH (CH 3) 2 CO + H 2 Ó 2. Se necessário, a acetona resultante também pode ser reduzida a álcool isopropílico.
Aplicação H 2 SOBRE 2 . O peróxido de hidrogênio é amplamente utilizado e sua produção global chega a centenas de milhares de toneladas por ano. É usado para produzir peróxidos inorgânicos, como oxidante para combustíveis de foguetes, em sínteses orgânicas, para branquear óleos, gorduras, tecidos, papel, para purificar materiais semicondutores, para extrair metais valiosos de minérios (por exemplo, urânio, convertendo sua forma insolúvel em solúvel), para tratamento de águas residuais. Na medicina, as soluções de H 2 O 2 são utilizadas para enxaguar e lubrificar em doenças inflamatórias das mucosas (estomatite, amigdalite) e no tratamento de feridas purulentas. Os estojos para lentes de contato às vezes têm uma quantidade muito pequena de catalisador de platina colocada na tampa. Para desinfetar as lentes, elas são colocadas em um estojo com uma solução de H 2 O 2 a 3%, mas como essa solução é prejudicial aos olhos, o estojo é virado depois de um tempo. Neste caso, o catalisador na tampa decompõe rapidamente o H 2 O 2 em água pura e oxigênio.
Já foi moda descolorir o cabelo com “peróxido”; agora existem compostos de coloração capilar mais seguros.
Na presença de certos sais, o peróxido de hidrogênio forma uma espécie de “concentrado” sólido, mais conveniente de transportar e usar. Assim, se H 2 O 2 for adicionado a uma solução saturada muito resfriada de borato de sódio (bórax), grandes cristais transparentes de peroxoborato de sódio Na 2 [(BO 2) 2 (OH) 4] se formam gradualmente. Essa substância é amplamente utilizada para branquear tecidos e como componente de detergentes. As moléculas de H 2 O 2, assim como as moléculas de água, são capazes de penetrar na estrutura cristalina dos sais, formando algo semelhante aos hidratos cristalinos - peroxohidratos, por exemplo, K 2 CO 3 · 3H 2 O 2, Na 2 CO 3 · 1,5H 20; o último composto é vulgarmente conhecido como "persol". A chamada “hidroperita” CO(NH 2) 2 ·H 2 O 2 é um clatrato - um composto de inclusão de moléculas de H 2 O 2 nos vazios da rede cristalina da ureia.
Na química analítica, o peróxido de hidrogênio pode ser usado para determinar alguns metais. Por exemplo, se o peróxido de hidrogênio for adicionado a uma solução de sal de titânio (IV), sulfato de titanila, a solução adquire uma cor laranja brilhante devido à formação de ácido pertitânico:
TiOSO 4 + H 2 SO 4 + H 2 O 2 H 2 + H 2 O. O íon molibdato incolor MoO 4 2– é oxidado por H 2 O 2 em um ânion peróxido intensamente laranja. Uma solução acidificada de dicromato de potássio na presença de H 2 O 2 forma ácido percrômico: K 2 Cr 2 O 7 + H 2 SO 4 + 5H 2 O 2 H 2 Cr 2 O 12 + K 2 SO 4 + 5H 2 O , que se decompõe rapidamente: H 2 Cr 2 O 12 + 3H 2 SO 4 Cr 2 (SO 4) 3 + 4H 2 O + 4O 2. Se somarmos essas duas equações, obtemos a reação de redução do dicromato de potássio com peróxido de hidrogênio:
K 2 Cr 2 O 7 + 4H 2 SO 4 + 5H 2 O 2 Cr 2 (SO 4) 3 + K 2 SO 4 + 9H 2 O + 4O 2.
O ácido percrômico pode ser extraído de uma solução aquosa com éter (é muito mais estável em solução de éter do que em água). A camada etérea fica de um azul intenso.
Ilya Leenson
LITERATURA
Dolgoplosk B.A., Tinyakova E.I. Geração de radicais livres e suas reações. M., Química, 1982 Química e tecnologia do peróxido de hidrogênio. L., Química, 1984
Peróxido de hidrogênio (peróxido de hidrogênio), 2 2 é o representante mais simples dos peróxidos. Líquido incolor com sabor “metálico”, infinitamente solúvel em água, álcool e éter. Soluções aquosas concentradas são explosivas. O peróxido de hidrogênio é um bom solvente. É liberado da água na forma de um hidrato cristalino instável H 2 O 2 2H 2 O.
A molécula de peróxido de hidrogênio tem a seguinte estrutura:
Propriedades quimicas
Ambos os átomos de oxigênio estão no estado de oxidação intermediário −1, o que determina a capacidade dos peróxidos de atuarem tanto como agentes oxidantes quanto como agentes redutores. Suas propriedades oxidantes mais características são:
Ao interagir com agentes oxidantes fortes, o peróxido de hidrogênio atua como agente redutor, oxidando em oxigênio:
A molécula de peróxido de hidrogênio é altamente polar, o que resulta em ligações de hidrogênio entre as moléculas. A ligação OO é frágil, então H 2 O 2 é um composto instável e se decompõe facilmente. A presença de íons de metais de transição também pode contribuir para isso. Em soluções diluídas, o peróxido de hidrogênio também não é estável e se desproporciona espontaneamente em H2O e O2. A reação de desproporção é catalisada por íons de metais de transição e algumas proteínas:
No entanto, o peróxido de hidrogênio muito puro é estável.
O peróxido de hidrogênio exibe propriedades ácidas fracas (K = 1,4 · 10 −12) e, portanto, dissocia-se em duas etapas:
Quando uma solução concentrada de H 2 O 2 atua sobre alguns hidróxidos, em alguns casos podem ser isolados peróxidos metálicos, que podem ser considerados sais de peróxido de hidrogênio (Li 2 O 2, MgO 2, etc.):
O peróxido de hidrogênio pode exibir propriedades oxidantes e redutoras. Por exemplo, ao interagir com o óxido de prata, é um agente redutor:
Na reação com nitrito de potássio, o composto atua como agente oxidante:
O grupo peróxido [-OO-] é encontrado em muitas substâncias. Tais substâncias são chamadas de peróxidos ou compostos de peróxido. Estes incluem peróxidos metálicos (Na 2 O 2, BaO 2, etc.). Os ácidos que contêm um grupo peróxido são chamados de peroxoácidos, por exemplo, ácidos peroxomonofosfóricos H 3 PO 5 e peroxidissulfúrico H 2 S 2 O 8.
Propriedades redox
O peróxido de hidrogênio tem propriedades oxidantes e também redutoras. Ele oxida nitritos em nitratos, libera iodo de iodetos metálicos e decompõe compostos insaturados no local das ligações duplas. O peróxido de hidrogênio reduz os sais de ouro e prata, bem como o oxigênio, ao reagir com uma solução aquosa de permanganato de potássio em meio ácido.
Quando o H 2 O 2 é reduzido, forma-se H 2 O ou OH-, por exemplo:
Quando exposto a agentes oxidantes fortes, o H 2 O 2 apresenta propriedades redutoras, liberando oxigênio livre:
Propriedades biológicas
O peróxido de hidrogênio é uma forma reativa de oxigênio e, quando produzido em excesso na célula, causa estresse oxidativo. Algumas enzimas, como a glicose oxidase, produzem peróxido de hidrogênio durante uma reação redox, que pode desempenhar um papel protetor como agente bactericida. As células dos mamíferos não possuem enzimas que reduzem o oxigênio a peróxido de hidrogênio. No entanto, vários sistemas enzimáticos (xantina oxidase, NAD(P)H oxidase, cicloxigenase, etc.) produzem superóxido, que é convertido espontaneamente ou sob a ação da superóxido dismutase em peróxido de hidrogênio.
Recibo
O peróxido de hidrogênio é produzido industrialmente por meio de uma reação envolvendo substâncias orgânicas, em especial, a oxidação catalítica do álcool isopropílico:
Um subproduto valioso desta reação é a acetona.
Em escala industrial, o peróxido de hidrogênio é produzido pela eletrólise do ácido sulfúrico, durante a qual se forma o ácido persulfúrico, e a posterior decomposição deste último em peróxido e ácido sulfúrico.
Em condições de laboratório, a seguinte reação é usada para produzir peróxido de hidrogênio:
A concentração e purificação do peróxido de hidrogênio são realizadas por destilação cuidadosa.
Aplicativo

Solução de peróxido de hidrogênio a 3%
Devido às suas fortes propriedades oxidantes, o peróxido de hidrogênio tem ampla aplicação na vida cotidiana e na indústria, onde é utilizado, por exemplo, como alvejante na produção têxtil e na produção de papel. É usado como combustível de foguete - como oxidante ou como combustível monocomponente (com decomposição em um catalisador). Utilizado em química analítica, como agente espumante na produção de materiais porosos e na produção de desinfetantes e alvejantes. Na indústria, o peróxido de hidrogênio também encontra utilização como catalisador, agente hidrogenante e como agente epoxidante na epoxidação de olefinas.
Embora soluções diluídas de peróxido de hidrogênio sejam usadas para pequenas feridas superficiais, estudos demonstraram que esse método proporciona efeito anti-séptico e de limpeza e prolonga o tempo de cicatrização. Embora o peróxido de hidrogênio tenha boas propriedades de limpeza, na verdade ele não acelera a cicatrização de feridas. Concentrações suficientemente elevadas que proporcionam um efeito anti-séptico também podem prolongar o tempo de cicatrização devido a danos nas células adjacentes à ferida. Além disso, o peróxido de hidrogênio pode interferir na cicatrização e promover cicatrizes ao destruir as células recém-formadas da pele. Entretanto, como meio de limpeza de feridas profundas de perfil complexo, vazamentos purulentos, flegmãos e outras feridas purulentas cuja higienização é difícil, o peróxido de hidrogênio continua sendo a droga de escolha. Pois além de ter efeito anti-séptico, também produz grande quantidade de espuma ao interagir com a enzima peroxidase. O que, por sua vez, permite amolecer e separar áreas necróticas, coágulos sanguíneos e pus dos tecidos, que podem ser facilmente removidos pela injeção subsequente de uma solução anti-séptica na cavidade da ferida. Sem o pré-tratamento com água oxigenada, a solução antisséptica não será capaz de remover essas formações patológicas, o que levará a um aumento significativo no tempo de cicatrização da ferida e piorará o estado do paciente.
O peróxido de hidrogênio também é usado para clarear cabelos e clarear dentes, mas o efeito em ambos os casos é baseado na oxidação e, portanto, na destruição dos tecidos e, portanto, tal uso (principalmente em relação aos dentes) não é recomendado por especialistas.
Perigo de uso
Pele após exposição a solução de peróxido de hidrogênio a 30%.
Apesar de o peróxido de hidrogênio não ser tóxico, suas soluções concentradas, se entrarem em contato com a pele, mucosas e vias respiratórias, causam queimaduras. Em altas concentrações, o peróxido de hidrogênio insuficientemente puro pode ser explosivo. Perigoso quando tomado por via oral em soluções concentradas. Causa mudanças destrutivas pronunciadas, semelhantes aos efeitos dos álcalis. A dose letal de uma solução de peróxido de hidrogênio a 30% (peridrol) é de 50-100 ml.
Ligações
Literatura
- Akhmetov N.S. Química geral e inorgânica. - M.: Ensino Superior, 2001.
- Karapetyants M. Kh., Drakin S. I. Química geral e inorgânica. - M.: Química, 1994.
Fundação Wikimedia. 2010.
- anfitriões
- Raquitismo
Veja o que é “Peróxido de Hidrogênio” em outros dicionários:
Peróxido de hidrogênio
Peróxido de hidrogênio- Peróxido de hidrogênio Geral Nome sistemático Peróxido de hidrogênio Fórmula química ... Wikipedia
Peróxido de bário- Geral... Wikipédia
PERÓXIDO DE HIDROGÊNIO- (peróxido de hidrogênio), H2O2, líquido, ponto de ebulição 150,2°C. Solução de peridrol de hidrogênio a 30%. Soluções aquosas concentradas de peróxido de hidrogênio são explosivas. O peróxido de hidrogênio é utilizado como agente oxidante em combustíveis de foguetes na produção de diversos... ... Enciclopédia moderna
Peróxido de hidrogênio- (peróxido de hidrogênio), H2O2, líquido, ponto de ebulição 150,2°C. Solução de peridrol de hidrogênio a 30%. Soluções aquosas concentradas de peróxido de hidrogênio são explosivas. O peróxido de hidrogênio é utilizado como agente oxidante em combustíveis de foguetes na produção de diversos... ... Dicionário Enciclopédico Ilustrado