หน้าท้องของ DNA ที่มีเกลียวคู่เพิ่มขึ้น อะไรสามารถมีอิทธิพลต่อผลลัพธ์? การประยุกต์ในด้านการแพทย์และพันธุศาสตร์
งานแสดงให้เห็นว่าแอนติบอดีที่มีสัมพรรคภาพต่ำและสัมพรรคภาพสูงที่มีประจุบวก คลาสไอจีจีถึง ดีเอ็นเอพื้นเมืองผู้บริจาค (IgG-Ab ถึง nDNA) และผู้ป่วยที่เป็นโรค Systemic lupus erythematosus (SLE) ในระยะที่กำเริบของโรคจะมีผลทางจีโนมพิษที่คล้ายกันต่อลิมโฟไซต์ของบุคคลที่มีสุขภาพดี ในหลอดทดลอง แอนติบอดีต่อ DNA ของผู้ป่วย SLE ในระยะเฉียบพลันซึ่งมีฤทธิ์ไฮโดรไลซ์ของ DNA แสดงความเป็นพิษต่อพันธุกรรมที่เด่นชัดมากขึ้นในเซลล์เม็ดเลือดขาวที่เพาะเลี้ยง พบว่าสเปกตรัมของการย่อยของสารพันธุกรรมในซีรั่มเลือดของผู้ป่วยโรคข้ออักเสบรูมาตอยด์นั้นกว้างกว่าในสภาวะปกติและใน SLE และแสดงด้วยแอนติบอดี IgG ที่มีความสัมพันธ์กับ nDNA สูง บทความกล่าวถึง เหตุผลที่เป็นไปได้การสร้างแอนติบอดีทางพยาธิวิทยาของคลาส IgG ไปยัง nDNA และพวกมัน บทบาททางชีววิทยาในร่างกาย
แอนติบอดีต่อ DNA
เซลล์เม็ดเลือดขาว
โรคลูปัส erythematosus ระบบ
โรคข้ออักเสบรูมาตอยด์
ความเป็นพิษต่อพันธุกรรม
1 อัคเบโรวา เอ็น.ไอ. การเปรียบเทียบข้อมูล II การทดสอบนัยสำคัญแบบไม่อิงพารามิเตอร์: คู่มือระเบียบวิธี- - คาซาน: สำนักพิมพ์ KSU, 2547 - 50 น.
2. อานิซิมอฟ เอ.จี. การรักษาเซลล์ K562 ที่ซิงโครไนซ์ด้วย tetrafluoroaluminate ไม่ได้ปรับการเรืองแสงของ ethidium bromide และ 4,6-diamidino-2-phenylindole เมื่อจับกับ nucleoid DNA / A.G. อานิซิมอฟ, ไอ.เอ. Bolotnikov // Cytology - 1999. - ต. 41. - หมายเลข 8. - หน้า 680-684
3. Arleevskaya M.I. เครื่องหมายวินิจฉัยและการพยากรณ์โรคข้ออักเสบรูมาตอยด์จากมุมมองของนักพยาธิสรีรวิทยา / M.I. อาร์ลีฟสกายา, A.G. Gabdulkhakova, A. Tsibulkin. - คาซาน: เรือ, 2010. - 128 น.
4. เนฟโซโรวา ที.เอ. ต้นกำเนิดและบทบาททางชีวภาพของ autoantibodies ต่อ DNA / T.A. Nevzorova, V.G. ฤดูหนาว // นักวิทยาศาสตร์. แซบ คาซาน. ยกเลิก เซอร์ เป็นธรรมชาติ ศาสตร์. - 2549. - ต. 148. - หนังสือ. 3. - หน้า 35-52.
5. ซาบีร์ซยาโนวา เอ.ซี. อิทธิพลของแอนติบอดี IgG ต่อ DNA ดั้งเดิมต่อโมโนไซต์ของมนุษย์ ในหลอดทดลอง / A.Z. Sabirzyanova, T.A. Nevzorova // วิทยาศาสตร์ แซบ คาซาน. ยกเลิก เซอร์ เป็นธรรมชาติ ศาสตร์. - 2551. - ต. 150. - หนังสือ. 2. - หน้า 186-200.
6. อาร์โดน เอส.พี. การพัฒนาความเข้าใจทางวิทยาศาสตร์ของโรคลูปัส / S.P. อาร์โดน, D.S. Pisetsky // การวิจัยและบำบัดโรคข้ออักเสบ. - 2551. - ฉบับที่. 10. - หมายเลข 5. - ร. 218-225.
7. กาบิบอฟ เอ.จี. ตัวเร่งปฏิกิริยา autoantibodies ในภูมิต้านตนเองทางคลินิกและการแพทย์แผนปัจจุบัน // Autoimmun Rev. - 2549. - ฉบับที่. 5. - หมายเลข 5. - ร. 324-330.
8. Kubota T. การเพิ่มประสิทธิภาพของความแตกแยกออกซิเดชันของ DNA โดยตำแหน่งที่มีผลผูกพันของแอนติบอดี DNA ที่ต่อต้านเกลียวคู่สองตัว // J. Biol เคมี. - พ.ศ. 2539. - เล่มที่. 271. - ลำดับที่ 11. - หน้า 6555-6561.
9. Rivadeneyra-Espinoza L. แอนติบอดีต่อ DNA ต่อต้านเจ้าของภาษาที่เจาะเซลล์ทำให้เกิดการตายของเซลล์ผ่านทางทั้งการละเลยและเส้นทางที่ตั้งโปรแกรมไว้ / L. Rivadeneyra-Espinoza, A. Ruiz-Argüelles // J Autoimmun - 2549. - ฉบับที่. 26. - ลำดับที่ 1. - ร. 52-56.
10. Yang R. เซลล์ Th1 และ Th2 ของ murine แบบ autopreactive ฆ่าแมคโครฟาจที่ทำงานร่วมกันและกระตุ้น autoantibodies // Lupus - พ.ศ. 2544. - ฉบับที่. 10. - หน้า 539-541.
เซลล์เม็ดเลือดขาวเป็นเซลล์หลัก ระบบภูมิคุ้มกันให้ภูมิคุ้มกันของร่างกายและควบคุมปฏิสัมพันธ์และการทำงานของเซลล์ที่ซับซ้อน สิ่งมีชีวิตหลายเซลล์ในระหว่างการตอบสนองของภูมิคุ้มกัน
การละเมิด กิจกรรมการทำงาน T- และ B-lymphocytes สะท้อนให้เห็นในการพัฒนา รูปแบบต่างๆภูมิคุ้มกันบกพร่อง
Systemic lupus erythematosus (SLE) และโรคข้ออักเสบรูมาตอยด์ (RA) เป็นโรคแพ้ภูมิตนเองเรื้อรัง (AIDs) ด้วย สาเหตุที่ไม่ชัดเจนและภาพรวมของภูมิคุ้มกันโรคที่กว้างขวาง ลดคุณภาพและอายุขัยของประชากร จึงเป็นหนึ่งในชีวการแพทย์ที่สำคัญและ ปัญหาสังคมความทันสมัย
ผู้ป่วยที่เป็นโรค SLE มีลักษณะเฉพาะคือการเพิ่มระดับของแอนติบอดี IgG ต่อ nDNA ซึ่งมีฤทธิ์ไฮโดรไลซ์ของ DNA และอาจเกี่ยวข้องกับกระบวนการทางพยาธิวิทยา แต่ปัจจุบันไม่มีความเห็นพ้องต้องกันระหว่างนักวิจัยเกี่ยวกับการมีส่วนร่วมของแอนติบอดีต่อ nDNA ในการพัฒนาและหลักสูตร AIZ
ใน RA ยังมีระดับแอนติบอดีไฮโดรไลซ์ DNA เพิ่มขึ้นด้วย แต่อาการทางคลินิกแตกต่างจาก SLE ดังนั้นกระบวนการทางพยาธิวิทยาจึงสามารถกำหนดได้ไม่เพียงแต่โดยระดับของแอนติบอดีต่อ DNA เท่านั้น แต่ยังรวมถึงคุณสมบัติของพวกมันซึ่งแตกต่างกันในโรคเอดส์ต่างๆ
วิจัย ปีที่ผ่านมาแสดงให้เห็นว่าแอนติบอดีต่อ DNA บางชนิดเจาะเข้าไปในเซลล์และส่งผลต่อกระบวนการภายในเซลล์
อาจแนะนำได้ว่าแอนติบอดี IgG ต่อ nDNA ซึ่งมีปฏิสัมพันธ์กับ DNA ของเซลล์และการเปลี่ยนแปลงโครงสร้างโครมาตินทำให้เกิดการหยุดชะงักของการตายของเซลล์ภูมิคุ้มกันบกพร่องส่งผลให้วัสดุอะพอพโทติกเพิ่มขึ้นและเวลาในการไหลเวียนในกระแสเลือดซึ่งสังเกตได้ใน SLE และทำให้รุนแรงขึ้นในกระบวนการแพ้ภูมิตัวเอง
วัตถุประสงค์ของงานคือเพื่อศึกษาความเป็นพิษต่อพันธุกรรมของแอนติบอดี IgG ต่อ DNA ดั้งเดิมในการเพาะเลี้ยงเซลล์เม็ดเลือดขาวปฐมภูมิจากบุคคลที่มีสุขภาพดี
วัสดุและวิธีการวิจัย
การคัดเลือกIgG-Ab ถึง nDNA จากซีรั่มของมนุษย์
ทุกขั้นตอนของการทำให้บริสุทธิ์ของการแยกและการทำให้บริสุทธิ์ของ IgG-ABs ต่อ nDNA จากซีรั่มของผู้บริจาคและผู้ป่วยที่มี SLE และ RA ได้ดำเนินการตามวิธีการที่พัฒนาขึ้นก่อนหน้านี้ ในงานนี้ เราใช้แอนติบอดีต่อ DNA จากซีรั่มในเลือดของผู้หญิง - 20 ซีรั่มจากผู้บริจาคที่มีสุขภาพดี, 7 ซีรั่มจากผู้ป่วย SLE และ 20 ซีรั่มจากผู้ป่วยโรค RA ในระหว่างการกำเริบของโรค ซึ่งได้รับใน สถาบันการแพทย์คาซาน. การวินิจฉัยโรค SLE และ RA ทำโดยนักกายภาพบำบัดที่มีคุณสมบัติจากสถาบันการแพทย์แห่งรัฐคาซานของหน่วยงานกลางเพื่อการพัฒนาสุขภาพและสังคม .
การแยกลิมโฟไซต์ออกจากเลือดครบของบุคคลที่มีสุขภาพดีดำเนินการตาม วิธีการมาตรฐานบน ficoll-verographin - ความหนาแน่น 1.077 มก./มล.
การเพาะเลี้ยงลิมโฟไซต์ในบริเวณนั้นIgG-Ab ถึง nDNA
ไปยังเซลล์ (2.10 4 เซลล์/หลุม), เจือจาง สภาพแวดล้อมที่สมบูรณ์ RPMI-1640 pH 7.4 (Gibco, สกอตแลนด์), ประกอบด้วยเซรั่มวัวของทารกในครรภ์ที่ไม่ทำงาน 10%, กลูตามีน 2 มิลลิโมลาร์ (เซอร์วา, เยอรมนี), เพนิซิลลิน 100 ยูนิต/มล. (รัสเซีย), สเตรปโตมัยซิน 100 ไมโครกรัม/มล. (รัสเซีย), เศษส่วนย่อยที่บริสุทธิ์ของ IgG - Abs ถึง nDNA จนถึงความเข้มข้นสุดท้ายที่ 1 μg/ml การทดลองแต่ละครั้งทำซ้ำสามครั้ง เซลล์ถูกบ่มที่ 37 ºС, 0.5% CO 2 เป็นเวลา 72 ชั่วโมง
จำนวนเม็ดเลือดขาวทั้งหมดและมีชีวิตหลังจากแยกออกจากเลือดครบส่วนและการฟักตัวด้วยการย่อยของ IgG-Abs ถึง nDNA พวกมันถูกกำหนดโดยวิธีแยกทริแพนบลู
การกำหนดระดับความเสียหายต่อ DNA นิวเคลียร์ของเซลล์หลังจากการเพาะเลี้ยงด้วยการย่อยของ IgG-Abs ถึง nDNA แล้ว จะใช้ฟลูออเรสเซนซ์สเปกโตรโฟโตมิเตอร์เพื่อวัดการเปลี่ยนแปลงในความเข้มของฟลูออเรสเซนซ์ของคอมเพล็กซ์ EB-DNA ของลิมโฟไซต์โครมาติน
การกำหนดระดับความเสียหายของ DNA นิวเคลียร์โดยเจลอิเล็กโตรโฟรีซิสของเซลล์เดี่ยวที่ถูกสลาย - "DNA-ดาวหาง"
ใช้สารละลาย 1% ของอะกาโรสที่ละลายต่ำ (ถังหมัก แคนาดา) ใน PBS เจล agarose 60 ไมโครลิตรพร้อมเซลล์ (2.10 · 4 - 5.10 · 4) ถูกนำไปใช้กับสไลด์ที่เคลือบด้วยโพลีไลซีน (ApexLab, รัสเซีย) กระจายเท่า ๆ กันและทิ้งไว้ 30 นาทีที่ +20 °C การสลายเซลล์ (10 mM Tris-HCl pH 10, 2.5 โมลาร์ NaCl, 100 มิลลิโมลาร์ EDTA-Na2, 1% ไทรทัน X-100, 5% DMSO, +4 °C) ถูกดำเนินการเป็นเวลา 1 ชั่วโมง จากนั้นแก้วถูกถ่ายโอนไปยังบัฟเฟอร์อิเล็กโทรโฟเรซิส (NaOH 300 มิลลิโมลาร์, EDTA-Na2 1 มิลลิโมลาร์, pH>13, +4 °C) และทิ้งไว้ 20 นาที อิเล็กโทรโฟเรซิสดำเนินการเป็นเวลา 20 นาทีที่ 1 โวลต์/ซม. และ 300 mA เมื่อเสร็จสิ้น สารเตรียมจะถูกถ่ายโอนไปยังสารละลายสำหรับการตรึง (70% เอทานอล) เป็นเวลา 15 นาที หลังจากนั้นนำไปทำให้แห้งที่อุณหภูมิ +20 °C (1-2 ชั่วโมง) เซลล์ที่ถูกบ่มเป็นเวลา 5 นาทีที่ -20°C โดยมี 100 ไมโครโมลาร์ H2O2 ถูกใช้เป็นตัวควบคุมเชิงบวกสำหรับการแสดงภาพการเสื่อมสลายของ DNA สารเตรียมถูกย้อมด้วยสีส้มอะคริดีน (20 ไมโครกรัม/มิลลิลิตร) เป็นเวลา 30 นาที และวิเคราะห์ด้วยกล้องจุลทรรศน์ฟลูออเรสเซนซ์ (AxioScope A1, Carl Zeiss, เยอรมนี) ด้วยตัวกรองที่เหมาะสม (ตัวกรองการกระตุ้น 490 นาโนเมตร, กระจกไดโครอิก 510, ตัวกรองจุดตัด 530 นาโนเมตร) ) กำลังขยาย 40 เท่า
การประมวลผลข้อมูลเชิงสถิติ
จากข้อมูลที่ได้รับเกี่ยวกับการเปลี่ยนแปลงความมีชีวิตและความเข้มของแสงเรืองแสงของเซลล์ EB-DNA ค่ามัธยฐาน 97.5 และ 2.5 เปอร์เซ็นไทล์ถูกคำนวณโดยใช้แพ็คเกจมาตรฐาน โปรแกรมเอ็กเซล Office 2003 นอกจากนี้ยังใช้เกณฑ์ของ Dunnett ด้วย
ผลการวิจัยและการอภิปราย
การเพิ่มขึ้นของระดับแอนติบอดีต่อ DNA-hydrolyzing นั้นพบได้ใน SLE และ RA แต่ภาพทางคลินิกของโรคนั้นแตกต่างกัน สันนิษฐานว่าแอนติบอดี IgG ต่อ nDNA เป็นตัวเหนี่ยวนำและผู้เข้าร่วม กระบวนการอักเสบกับ AIZ แต่สิ่งที่กำหนดศักยภาพในการก่อโรคและวิธีการรับรู้ในร่างกายนั้นยังไม่เป็นที่เข้าใจอย่างถ่องแท้
ดังนั้นเพื่อความเข้าใจที่ลึกซึ้งยิ่งขึ้นเกี่ยวกับบทบาทของแอนติบอดีต่อ nDNA ในการเหนี่ยวนำและการลุกลาม โรคแพ้ภูมิตัวเองประเมินการพึ่งพาความเป็นพิษต่อพันธุกรรมของแอนติบอดี IgG ต่อ nDNA ในคุณสมบัติทางเคมีกายภาพและอิมมูโนเคมี
จากแต่ละซีรั่ม จะได้รับ IgG-Abs ที่ปราศจากสารเชิงซ้อนภูมิคุ้มกัน 4 ส่วนไปยัง nDNA ซึ่งประจุต่างกัน (เศษส่วน I มีลักษณะเป็นประจุบวกโดยรวม และเศษส่วน II ที่มีประจุลบโดยรวม) และความสัมพันธ์สำหรับ nDNA - เศษส่วนย่อย a ชะออกจากบัฟเฟอร์เซลลูโลส nDNA ที่มี NaCl 1 โมลาร์ และเศษส่วนย่อย b ซึ่งชะออกจากตัวดูดซับด้วยบัฟเฟอร์ Gly-HCl ที่มีค่า pH 2.3 ซึ่งช่วยให้เราสามารถสมมติความสัมพันธ์ที่มากขึ้นกับแอนติเจนได้
แสดงให้เห็นว่าเมื่อมี IgG-AB ที่มีประจุบวกต่อผู้บริจาค nDNA จำนวนและจำนวนลิมโฟไซต์ที่มีชีวิตทั้งหมดจะลดลงเมื่อเปรียบเทียบกับกลุ่มควบคุม (PBS) (รูปที่ 1) IgG-ABs ต่อ nDNA ของผู้ป่วย SLE ในระยะที่กำเริบของโรคมีผลคล้ายกันกับเซลล์เม็ดเลือดขาวของบุคคลที่มีสุขภาพดีเช่นเดียวกับ AB จากผู้บริจาค แต่ผลของมันจะเด่นชัดกว่าซึ่งอาจเนื่องมาจากกิจกรรมการไฮโดรไลซ์ DNA สูง
ขาดผู้บริจาค อาการทางคลินิกโรคที่มีผลคล้ายกันต่อเซลล์ของ IgG-Abs ถึง nDNA ของผู้บริจาคและผู้ป่วยที่เป็นโรค SLE ในระยะที่กำเริบของโรคนั้นอธิบายได้จากข้อเท็จจริงที่ว่าระดับของ IgG-Abs ถึง nDNA ในเลือด คนที่มีสุขภาพดีต่ำกว่าผู้ป่วยโรค SLE อย่างเห็นได้ชัด นอกจากนี้ แอนติบอดี IgG ส่วนใหญ่ต่อ nDNA ในเลือดของบุคคลที่มีสุขภาพดีนั้นเป็นส่วนหนึ่งของภูมิคุ้มกันเชิงซ้อนที่มีแอนติบอดีต่อต้านลักษณะเฉพาะหรือไบโอโพลีเมอร์ที่มีประจุลบซึ่งมีโครงสร้างคล้ายกับ DNA
ในกระบวนการแยก IgG-Abs เป็น nDNA จากซีรั่ม การทำลายคอมเพล็กซ์ภูมิคุ้มกันของ Ab-DNA เกิดขึ้นพร้อมกับการก่อตัวของ Abs อิสระเป็น nDNA และในการทดลองกับเซลล์เม็ดเลือดขาวเราใช้ความเข้มข้นเท่ากันของ Abs ที่ทดสอบทั้งหมด จึงได้รับโอกาส เพื่อสังเกตศักยภาพ ผลเสียบนเซลล์ ในหลอดทดลองที่ผู้บริจาค
ข้าว. 1. การเปลี่ยนแปลง จำนวนทั้งหมดและจำนวนลิมโฟไซต์ที่มีชีวิตของบุคคลที่มีสุขภาพดีหลังจากการฟักตัวเป็นเวลา 72 ชั่วโมงที่อุณหภูมิ 37 °C โดยมีเศษส่วนย่อย ไอจีจี-AT ถึง nDNA:
Ia - แอนติบอดี IgG ที่มีประจุบวกที่มีประจุบวกต่ำต่อ nDNA;
IIa - แอนติบอดี IgG ที่มีประจุลบที่มีประจุลบต่อ nDNA;
Ib - IgG-ABs ที่มีความสัมพันธ์สูงที่มีประจุบวกกับ nDNA;
IIb - IgG-ABs ที่มีสัมพรรคภาพสูงที่มีประจุลบกับ nDNA
มีแนวโน้มว่า SLE Abs ทางพยาธิวิทยาไปจนถึง nDNA อาจเกิดจาก Abs ตามธรรมชาติที่ทำหน้าที่ ฟังก์ชั่นการป้องกันแต่คำถามเกี่ยวกับสาเหตุของการสลับที่ผิดปกติดังกล่าวยังคงเปิดอยู่
แสดงให้เห็นเป็นครั้งแรกว่าสเปกตรัมของการย่อยพิษต่อเซลล์ของ IgG-ABs ถึง nDNA ในซีรั่มเลือดของผู้ป่วย RA แตกต่างจากบรรทัดฐานและ SLE นอกเหนือจากแอนติบอดีที่มีสัมพรรคภาพต่ำที่มีประจุบวกต่อ DNA คุณลักษณะของผู้บริจาคและผู้ป่วยโรค SLE การแยกส่วนย่อยที่มีประจุบวกและประจุลบของ IgG-ABs ต่อ nDNA ของผู้ป่วยโรค RA ที่มีความสัมพันธ์เชิงบวกสูง ยังนำไปสู่การลดลงอย่างเห็นได้ชัดในการแพร่กระจายและจำนวนเซลล์เม็ดเลือดขาวที่มีชีวิต ของบุคคลที่มีสุขภาพดี ในหลอดทดลอง.
ศึกษาการเปลี่ยนแปลงของการควบแน่นของลิมโฟไซต์โครมาตินหลังจากการสัมผัสกับเศษส่วนย่อยของ IgG-Ab ต่อ nDNA ถูกศึกษาโดยฟลูออเรสเซนซ์สเปกโตรโฟโตมิเตอร์ การก่อตัวของการแตกตัวใน DNA นำไปสู่การย่อยสลายโครมาติน, การเพิ่มขึ้นของตำแหน่งการจับของ EB ด้วยกรดนิวคลีอิกและการเรืองแสงที่เพิ่มขึ้นของคอมเพล็กซ์ EB-DNA
นอกจากนี้ ความเป็นพิษต่อพันธุกรรมของแอนติบอดี IgG ต่อ nDNA ได้รับการประเมินโดยใช้วิธี "DNA comet" ในกรณีที่มีการแตกตัวของ DNA โครงสร้างโครงสร้างของโครมาตินจะหยุดชะงักและการสูญเสียซูเปอร์คอยล์ไป ซึ่งนำไปสู่การผ่อนคลายของโมเลกุล ในสนามไฟฟ้า วงรีแลกซ์และชิ้นส่วน DNA จะถูกดึงเข้าหาขั้วบวก ซึ่งทำให้วัตถุที่สังเกตได้ดูเหมือน "ดาวหาง" ความยาวและโครงสร้างของ “หางของดาวหาง” สามารถใช้เพื่อตัดสินระดับการสลายตัวของ DNA ของเซลล์ได้
การเพิ่มขึ้นของความเข้มของการเรืองแสงของคอมเพล็กซ์ EB-DNA ในตัวอย่างที่บ่มด้วยแอนติบอดี IgG ที่มีประจุบวกกับ nDNA (Ia, Ib) จากผู้บริจาคบ่งบอกถึงการเปลี่ยนแปลงในโครงสร้าง DNA ของเซลล์โครมาติน - การกำจัด supercoiling และ การศึกษาที่เป็นไปได้การแตกร้าว (ตารางที่ 1) ภาพไมโครกราฟทั่วไปของวัตถุหลังจากการฟักตัวของเซลล์ที่มี IgG-Abs ที่มีประจุบวกไปจนถึง nDNA เผยให้เห็นการก่อตัวของ "หางดาวหาง" (รูปที่ 2B) ซึ่งไม่ได้สังเกตพบในการควบคุมเชิงลบของ PBS (รูปที่ 2A) และเป็นภาพสะท้อนของ ความเป็นพิษต่อพันธุกรรมของ Abs ต่อ DNA อาจเป็นไปได้ว่า Abs ที่มีผลผูกพันกับ DNA จากผู้บริจาคซึ่งเจาะเข้าไปในเซลล์สามารถไปถึงนิวเคลียส ผูกกับ DNA และเปลี่ยนโครงสร้างของมัน ตัวอย่างเช่น มีการแสดงให้เห็นว่า ATs ในบริเวณที่มีผลผูกพันกับ DNA ช่วยเพิ่มการทำลายโดยอนุมูลไฮดรอกซิลอย่างมีนัยสำคัญ เป็นไปได้ว่า Abs ถึง nDNA มีส่วนช่วยในการทำลาย nDNA แบบออกซิเดชัน โดยเปลี่ยนโครงสร้างของมัน ทำให้พื้นที่จำกัดสามารถเข้าถึงอนุมูลไฮดรอกซิลได้
ตารางที่ 1- การเปลี่ยนแปลงระดับการเรืองแสงของโครมาติน EB-DNA ของลิมโฟไซต์หลังการฟักตัว 72 ชั่วโมงที่อุณหภูมิ 37 °C โดยมีเศษส่วนย่อยไอจีจี-AT ถึง nDNA
|
ส่วนย่อย ไอจีจี-AT ถึง nDNA |
ความเข้มของแสงเรืองแสงของคอมเพล็กซ์ EB-DNA หน่วย/เซลล์ |
|||
|
ผู้บริจาค |
การควบคุม (FSB) |
|||
|
สัมพรรคภาพต่ำที่มีประจุบวก |
7.85 (6.75; 8.32) |
9.52 (9.27; 11.06) |
8.51 (8.40; 8.91) |
6.67 (5.75; 6.85) |
|
ความสัมพันธ์ต่ำที่มีประจุลบ |
5.56 (5.04; 6.80) |
6.95 (6.49; 7.12) |
5.98 (5.53; 6.19) |
|
|
ประจุบวกมีความสัมพันธ์สูง |
9.10 (8.94; 9.15) |
9.82 (9.25; 9.94) |
9.52 (9.24; 9.64) |
|
|
ความสัมพันธ์สูงที่มีประจุลบ |
6.40 (5.64; 7.07) |
6.64 (6.46; 7.67) |
7.60 (6.96; 9.33) |
|
ผลเสียต่อโครงสร้างโครมาติน DNA ของเซลล์เม็ดเลือดขาวที่มีประจุบวกกับ subfractions ของ IgG-ABs ถึง nDNA (Ia, Ib) ของผู้ป่วย SLE ในระยะที่กำเริบของโรคนั้นเด่นชัดกว่าเมื่อเปรียบเทียบกับแอนติบอดีของผู้บริจาคซึ่งสะท้อนให้เห็นใน เพิ่มขึ้นอย่างรวดเร็วการเรืองแสงของคอมเพล็กซ์ EB-DNA ภาพจุลภาคทั่วไปของ “ดาวหาง DNA” แสดงการก่อตัวของ “หางดาวหาง” ที่กระจายเป็นวงกว้าง (รูปที่ 2D) ซึ่งเป็นหลักฐาน ระดับสูงการย่อยสลาย DNA ของลิมโฟไซต์ภายใต้อิทธิพลของแอนติบอดีต่อ DNA ของผู้ป่วย SLE ความเป็นพิษต่อพันธุกรรมของ IgG-Abs ต่อ nDNA ของผู้ป่วย SLE ในระหว่างการกำเริบของโรคนั้นเทียบได้กับผลของไฮโดรเจนเปอร์ออกไซด์ที่ใช้ในการทดลองนี้เป็นการควบคุมเชิงบวก (รูปที่ 2B) เป็นไปได้ว่าเมื่อรวมกับการจับกับ DNA แล้ว SLE-AB ที่ทำปฏิกิริยาไฮโดรไลซ์ DNA ในเซลล์ซึ่งไปถึงนิวเคลียส ก็สามารถทำหน้าที่เป็นตัวเร่งปฏิกิริยาทางชีวภาพสำหรับการไฮโดรไลซิสของพันธะฟอสโฟไดสเตอร์ของ DNA และด้วยเหตุนี้จึงแสดงความเป็นพิษต่อพันธุกรรม

ข้าว. 2. ภาพถ่ายไมโครของ “ดาวหาง DNA” หลังจากการฟักตัวของเม็ดเลือดขาวลิมโฟไซต์ที่อุณหภูมิ 37°C เป็นเวลา 72 ชั่วโมง จากบุคคลที่มีสุขภาพดีซึ่งมี subfractionsไอจีจี-AT ถึง nDNA:
เอ - การควบคุมเชิงลบ(เอฟเอสบี); B - การควบคุมเชิงบวก (H 2 O 2);
B - ดาวหาง DNA ทั่วไปที่สังเกตได้หลังจากได้รับลิมโฟไซต์ถึง subfractions Ia และ Ib ของ IgG-AT ไปยังผู้บริจาค nDNA;
D - ดาวหาง DNA ทั่วไปที่สังเกตได้หลังจากได้รับลิมโฟไซต์ถึง subfractions Ia และ Ib ของ IgG-Abs ถึง nDNA ของผู้ป่วย SLE
D - ดาวหาง DNA ทั่วไปที่สังเกตได้หลังจากได้รับลิมโฟไซต์ถึง subfractions Ia, Ib และ IIb ของ IgG-Abs ถึง nDNA ของผู้ป่วย RA
จากผลลัพธ์ที่ได้รับ เราสามารถสรุปได้ว่าสำหรับผู้บริจาค Abs และ SLE-Abs เมื่อสัมผัสกับเซลล์ ในหลอดทดลอง มูลค่าที่สูงขึ้นมีค่าใช้จ่ายในโมเลกุล IgG-AT ต่อ nDNA แทนที่จะเป็นความสัมพันธ์กับแอนติเจน
พบว่าใน RA สเปกตรัมของการย่อยทางพันธุกรรมนั้นกว้างกว่าในสภาวะปกติและใน SLE - การเพิ่มขึ้นของการเรืองแสงของคอมเพล็กซ์ EB-DNA ของเซลล์โครมาตินจะถูกสังเกตหลังจากการฟักตัวของลิมโฟไซต์ที่มีประจุบวก subfractions ความสัมพันธ์ต่ำที่มีประจุบวก (Ia ) เช่นเดียวกับการย่อยความสัมพันธ์สูงของ IgG-Abs ต่อ nDNA ของผู้ป่วยที่เป็นโรค RA ในช่วงที่อาการกำเริบของโรคทั้งที่มีประจุบวกและลบ (Ib, IIb) เมื่อการย่อยของ IgG-Abs ถึง nDNA เหล่านี้ถูกสัมผัสกับเซลล์หลังจากอิเล็กโตรโฟรีซิส จะสังเกตเห็นการก่อตัวของ "หางดาวหาง" ที่กระจายในวงกว้าง (รูปที่ 2E) ซึ่งบ่งบอกถึงการก่อตัวของการแตกใน DNA ของลิมโฟไซต์ ซึ่งเป็นผลมาจาก ความเป็นพิษต่อพันธุกรรมสูงของ Abs ต่อ DNA ใน RA จากผลลัพธ์ที่ได้รับเราสามารถสรุปได้ว่าใน RA ศักยภาพในการทำให้เกิดโรคของแอนติบอดี IgG ต่อ nDNA ไม่ได้ถูกกำหนดโดยประจุของโมเลกุล แต่โดยความสัมพันธ์ของแอนติบอดีต่อแอนติเจน - DNA ดั้งเดิม สิ่งนี้ช่วยให้เราสามารถแนะนำลักษณะที่แตกต่างกันในตอนแรกของการก่อตัวของแอนติบอดี IgG ทางพยาธิวิทยาต่อ nDNA ใน RA
มีแนวโน้ม, เพิ่มขึ้นผิดปกติระดับเลือดของแอนติบอดีตามธรรมชาติต่อ DNA ใน เงื่อนไขบางประการสามารถนำไปสู่ความเสียหายต่อเซลล์ของระบบภูมิคุ้มกัน การเปลี่ยนแปลงกิจกรรมการทำงาน และการแสดงออกของยีน ซึ่งอาจส่งผลให้เกิดการละเมิดได้ สถานะภูมิคุ้มกันและการชักนำให้เกิดโรคภูมิต้านตนเองเนื่องจากการตายของเซลล์ที่รุนแรงขึ้น เซลล์ที่แข็งแรงและการสะสมของ B-lymphocytes ที่ถูกดัดแปลงซึ่งสร้าง IgG-ATs ทางพยาธิวิทยาเป็น nDNA ดังนั้น IgG-Abs ไปยัง nDNA จึงเป็นหนึ่งในการเชื่อมโยงที่สำคัญของระบบภูมิคุ้มกัน สะท้อนการเปลี่ยนแปลงในสถานะภูมิคุ้มกัน และมีส่วนร่วมในการรักษาสภาวะสมดุลในสิ่งมีชีวิตหลายเซลล์
ผู้วิจารณ์:
- Chikov V.I. วิทยาศาสตรดุษฎีบัณฑิต ศาสตราจารย์ สถาบัน สถาบันการศึกษารัสเซียสถาบันชีวเคมีและชีวฟิสิกส์คาซานวิทยาศาสตร์คาซาน ศูนย์วิทยาศาสตร์ราส, คาซาน.
- Gabdrakhmanova L.A. วิทยาศาสตรดุษฎีบัณฑิตสาขาวิทยาศาสตร์ชีวภาพ นักวิจัยอาวุโส หัวหน้าแผนกการศึกษาของสถาบันการศึกษางบประมาณของรัฐบาลกลางด้านการศึกษาวิชาชีพระดับสูง "มหาวิทยาลัยพลังงานแห่งรัฐคาซาน" คาซาน
รับงาน 10/03/2554
ลิงค์บรรณานุกรม
Sabirzyanova A.Z., Nevzorova T.A. แอนติบอดีต่อ DNA ในเลือดของผู้ป่วยที่มีโรคลูปัส erythematosus และโรคข้ออักเสบรูมาตอยด์แสดงความเป็นพิษต่อพันธุกรรมในวัฒนธรรมปฐมภูมิของลิมโฟไซต์ของบุคคลที่มีสุขภาพดี // ประเด็นร่วมสมัยวิทยาศาสตร์และการศึกษา – 2554 – ลำดับที่ 5.;URL: https://science-education.ru/ru/article/view?id=4811 (วันที่เข้าถึง: 22/12/2017) เรานำเสนอนิตยสารที่คุณจัดพิมพ์โดยสำนักพิมพ์ "Academy of Natural Sciences"
คำอธิบายของการศึกษา
โรคภูมิต้านตนเอง, โรคข้อ -
กำหนดเวลา: 10 วันทำการ*.วัสดุชีวภาพ: เซรั่มเลือด.
คำอธิบาย:
ความเป็นไปได้ของการวิจัยเร่งด่วน: ใช่ ล่วงหน้า 1 วัน
การเตรียมตัวสำหรับการศึกษา: ไม่จำเป็นต้องมีการเตรียมตัวพิเศษสำหรับการศึกษา
ระเบียบวิธี: เอนไซม์อิมมูโนแอสเสย์
อ้างอิง: Anti-dsDNA เป็นแอนติบอดีต่อต้านนิวเคลียร์ชนิดหนึ่ง แอนติบอดีเหล่านี้มีความเฉพาะเจาะจงสูงสำหรับโรคลูปัส erythematosus (SLE) แต่ยังสามารถเกิดขึ้นได้ในโรคอื่น ๆ ที่แพร่กระจาย เนื้อเยื่อเกี่ยวพันบ่อยน้อยกว่ามากและมีความเข้มข้นต่ำกว่าเท่านั้น ระดับของแอนติบอดีต่อต้าน dsDNA ในผู้ป่วยโรค SLE มีความสัมพันธ์โดยตรงกับความเข้มข้นของสารเชิงซ้อนการไหลเวียนที่มี IgG (CEC) ซึ่ง เพิ่มความเข้มข้นพบในไตของผู้ป่วยโรค SLE รุนแรง พยาธิวิทยาของไต- DNA ที่มีเกลียวคู่มีความสามารถในการจับกับเยื่อหุ้มชั้นใต้ดินของ glomeruli ซึ่งทำให้เกิดการก่อตัวของภูมิคุ้มกันเชิงซ้อนใน glomeruli โดยตรง การสะสมของคอมเพล็กซ์ภูมิคุ้มกันนำไปสู่การกระตุ้นการทำงานของส่วนประกอบและเป็นผลให้เกิดการอักเสบและความเสียหายของเนื้อเยื่อ
บ่งชี้ในการใช้งาน: การวินิจฉัยโรคลูปัส erythematosus แบบเป็นระบบ การติดตามอาการ การพยากรณ์โรค และการควบคุมการรักษาในผู้ป่วยโรค SLE
หน่วยวัด: ยู/มล
ตัวชี้วัดปกติ:
ค่าอ้างอิง:
- <20 Ед/мл (отрицательно);
- 20 - 25 U/ml (สงสัย);
- >25 U/ml (บวก)
การตีความผลลัพธ์: ความจำเพาะในการวินิจฉัยของการทดสอบ anti-dsDNA IgG สำหรับ SLE (นั่นคือ เปอร์เซ็นต์ของผลการทดสอบเชิงลบในกรณีที่ไม่มีโรค) คือ 98% ในประชากรทั่วไปของบุคคลที่มีสุขภาพดี และ 87% ในผู้ป่วยที่เป็นโรคภูมิต้านตนเองอื่นๆ ความไวในการวินิจฉัยของการทดสอบ SLE (เปอร์เซ็นต์ของผลการทดสอบที่เป็นบวกเมื่อมีโรค) คือ 85%
ความเข้มข้นของแอนติบอดีจะเปลี่ยนแปลงไปตามกิจกรรมของ SLE ระดับของแอนติบอดีต่อต้าน dsDNA IgG ในผู้ป่วยโรค SLE มีความสัมพันธ์กับความรุนแรงของไตอักเสบ ก็เผยออกมาว่า ความเข้มข้นสูงการไหลเวียนของแอนติบอดีต่อ DNA ที่มีเกลียวคู่และการลดลงของเนื้อหาของส่วนประกอบเสริม C3, C4 มักจะนำหน้าการโจมตีของ glomerulonephritis ที่ใช้งานอยู่หรือรวมกับมัน อย่างไรก็ตามทันทีที่เกิดการกำเริบของ glomerulonephritis ระดับของแอนติบอดีอาจลดลง
โรคที่มีระดับ Anti-dsDNA เพิ่มขึ้น:
- โรคลูปัส erythematosus ระบบ (SLE);
- โรคข้ออักเสบรูมาตอยด์;
- โรคหนังแข็ง;
- กลุ่มอาการของโจเกรน;
- โรคตับอักเสบเรื้อรังที่ใช้งานอยู่
- โรคตับแข็งทางเดินน้ำดี;
- การติดเชื้อที่เกิดจาก ไวรัสเอพสเตน-บาร์และการติดเชื้อไซโตเมกาโลไวรัส
ในกรณีที่แยกได้ (น้อยกว่า 2%) สามารถสังเกตแอนติบอดีต่อต้าน dsDNA IgG ที่มีความเข้มข้นต่ำในคนที่ไม่มีเลย อาการทางคลินิกโรคแพ้ภูมิตัวเอง
ความสนใจ!!!ควรจำไว้ว่าในสัดส่วนเล็กน้อยของผู้ป่วยที่มี SLE anti-dsDNA antibodies จะไม่ถูกตรวจพบ ดังนั้นเมื่อ ผลลัพธ์เชิงลบการทดสอบไม่สามารถยกเว้นโรคนี้ได้อย่างสมบูรณ์
13.04.2015 13.10.2015
ระบบภูมิคุ้มกัน ร่างกายมนุษย์เป็นผู้พิทักษ์สุขภาพและความปลอดภัยของเขา ทันทีที่ศัตรูเข้ามา การตอบสนองทางภูมิคุ้มกันก็จะเกิดขึ้น นั่นคือเซลล์ที่ผูกมัดกับเอเลี่ยนและทำลายมัน โดยสังเวยชีวิตของมัน แต่ทิ้งผู้ติดตามที่เตรียมพร้อมที่จะต่อสู้กับศัตรูรายนี้ไว้เบื้องหลัง การรบกวนในระบบการทำงานที่ดีนี้ทำให้เกิด โรคร้ายแรงซึ่งยังคงรักษาไม่หาย
การตรวจจับในซีรั่มของมนุษย์ ระดับที่เพิ่มขึ้น IgG ถึง DNA ที่มีเกลียวคู่ทำให้สามารถรับรู้ถึงการมีอยู่ของโรคแพ้ภูมิตนเอง ติดตามการพัฒนาของโรคและประสิทธิผลของการรักษา
คำอธิบาย
แอนติบอดีต่อ ดีเอ็นเอเกลียวคู่เป็นตัวแทนของออโตแอนติบอดีที่ผลิตโดยระบบภูมิคุ้มกันเพื่อต่อต้านนิวเคลียสของเซลล์ในร่างกายของตัวเอง การมีอยู่ของโปรตีนเหล่านี้ในสาย DNA บ่งบอกถึงการพัฒนาของโรคที่ส่งผลต่อเนื้อเยื่อเกี่ยวพันภายใน
หลัก คุณลักษณะเฉพาะโรคภูมิต้านตนเองซึ่งเซลล์เนื้อเยื่อเกี่ยวพันทำลายตัวเองคือการก่อตัวของแอนติบอดีต่อต้านนิวเคลียร์ (ANA) แอนติบอดีต่อ DNA เป็นโปรตีนอีกประเภทหนึ่งที่มีความสามารถในการเจาะและทำลายนิวเคลียสภายในเซลล์
ครั้งหนึ่ง ANA แบ่งออกเป็นสองประเภทหลัก:
- แอนติบอดีต่อฮิสโตนและสาย DNA ซึ่งรวมถึงโปรตีนทางพยาธิวิทยาที่ผลิตขึ้นเพื่อต่อต้านสายคู่ของ DNA หรือที่เรียกว่า anti-dsDNA
- แอนติบอดีต่อแอนติเจนที่สกัดด้วยนิวเคลียร์ได้ แอนติเจนเหล่านี้มีชื่อ - สกัดได้หรือ ENA - เนื่องจากพวกมันถูกแยกออกจากนิวเคลียสของเซลล์ น้ำเกลือ- ซึ่งรวมถึง:
- ไรโบนิวคลีโอโปรตีน,
- แอนติเจนของSjögren "A" และ "B"
- SCL-70 และ PM-1
คำนิยาม ประเภทเฉพาะแอนติบอดีต่อต้านนิวเคลียร์ร่วมกับ อาการทางคลินิกทำให้สามารถกำหนดได้ว่าสิ่งใดเฉพาะเจาะจง โรคแพ้ภูมิตัวเองผู้ป่วยได้รับผลกระทบ ดังนั้นจึงพบว่าการตรวจพบแอนติบอดีต่อต้าน DNA ในระดับสูงในเลือดเป็นลักษณะเฉพาะ โรคลูปัสอย่างเป็นระบบ.
บทบาทของแอนติบอดีต่อ DNA ดั้งเดิมในการพัฒนาโรคลูปัส erythematosus
Lupus erythematosus - lupus erythematosus เป็นที่รู้จักในด้านการแพทย์มาตั้งแต่ปี 1828 จากนั้นแพทย์ผิวหนังชาวฝรั่งเศส Laurent Biett ได้บรรยายถึงอาการทางผิวหนังที่เกิดขึ้นกับโรคนี้เป็นครั้งแรก ต่อมานักวิทยาศาสตร์สังเกตเห็นสัญญาณของความผิดปกติของอวัยวะภายในในผู้ป่วย และนักบำบัดชาวอังกฤษชื่อดัง William Osler ในปี พ.ศ. 2433 พบว่าในบางกรณีโรคลูปัสสามารถเกิดขึ้นได้โดยไม่มีการเปลี่ยนแปลง ผิว- จากนั้นแพทย์ฝึกหัดต้องเผชิญกับคำถามเกี่ยวกับความเป็นไปได้ในการวินิจฉัยโรคไม่เพียงแต่จากอาการทางคลินิกเท่านั้น
แต่เพียงกว่า 50 ปีต่อมา ได้มีการค้นพบปรากฏการณ์ของเซลล์แอลอีซึ่งในนั้น เลือดกำลังไหลการก่อตัวของเม็ดเลือดขาวซึ่งส่วนใหญ่เป็นนิวโทรฟิลที่มีอนุภาค phagocytosed ที่ตายแล้วของนิวเคลียสที่อยู่ในเซลล์อื่น และในปี พ.ศ. 2497 มีการค้นพบโปรตีนที่ผิดปกติของระบบภูมิคุ้มกันในซีรั่มของผู้ป่วยซึ่งการกระทำดังกล่าวมุ่งเป้าไปที่เพื่อนของพวกเขา เริ่ม เวทีใหม่ในประวัติศาสตร์ของการศึกษาโรคลูปัสอย่างเป็นระบบ ตอนนี้หมอได้มีโอกาส การวินิจฉัยที่เชื่อถือได้โรคเกี่ยวกับ ระยะแรกตลอดจนควบคุมการพัฒนาอาการของโรค
หลักการวิจัย
ในห้องปฏิบัติการสมัยใหม่ จะใช้การพิจารณาการมีอยู่ของแอนติบอดีต่อต้านนิวเคลียร์และต่อต้าน dsDNA โดยเฉพาะ  วิธีอิมมูโนฟลูออเรสเซนต์ทางอ้อมหรือมากกว่า ประเภทที่ละเอียดอ่อนการวิจัย - เอนไซม์อิมมูโนแอสเสย์
วิธีอิมมูโนฟลูออเรสเซนต์ทางอ้อมหรือมากกว่า ประเภทที่ละเอียดอ่อนการวิจัย - เอนไซม์อิมมูโนแอสเสย์
เพื่อสร้างประเภท โรคทางระบบเนื้อเยื่อเกี่ยวพันภายในและความแตกต่างจากโรคอื่น ๆ จำเป็นต้องคำนึงถึงความจำเพาะของการศึกษาด้วย ในหลายกรณี พลาสมาของผู้ป่วยอาจมีโปรตีนเชิงรุกหลายประเภท และการทดสอบส่วนใหญ่ออกแบบมาเพื่อยืนยันเพียงชนิดเดียว บางประเภท- ความจำเพาะของการทดสอบการมีอยู่ของแอนติบอดีต่อ DNA สายคู่คือ 99% ซึ่งช่วยให้ผลลัพธ์สามารถวินิจฉัย SLE ได้อย่างแม่นยำ แม้ว่าการทดสอบ ANA จะแสดงผลเป็นลบก็ตาม
การประยุกต์ในด้านการแพทย์และพันธุศาสตร์
ได้รับการจัดตั้งและยืนยันโดยการวิจัยว่าคอมเพล็กซ์ที่สร้างขึ้นจาก DNA ดั้งเดิมและอิมมูโนโกลบูลินเช่น IgG และ IgM ก่อให้เกิดลักษณะอาการของโรคนี้โดยตรงซึ่งแสดงออกในการทำลายเนื้อเยื่อของอวัยวะภายในเกือบทั้งหมด
ข้อมูลเกี่ยวกับการปรากฏตัวของสารก่อมะเร็งในเลือดเป็นสิ่งสำคัญสำหรับผู้ป่วยที่ไม่มีโรคดำเนินไป อาการภายนอก- มีความเป็นไปได้ที่จะตรวจพบโปรตีนที่ผิดปกติใน DNA ที่มีเกลียวคู่เป็นเวลาหลายปีก่อนที่สัญญาณการทำลายล้างครั้งแรกจะปรากฏในร่างกาย คนดังกล่าวได้รับการขึ้นทะเบียนและได้รับการตรวจร่างกายเป็นประจำโดยแพทย์โรคไขข้อ
การวิเคราะห์การมีอยู่ของเซลล์ที่ผิดปกติใน DNA ดั้งเดิมมีความสำคัญอย่างยิ่งในโรคลูปัสของทารกแรกเกิด โรคประเภทนี้สามารถเกิดได้ในทารกแรกเกิดที่มารดาป่วยเป็นโรค SLE หรืออื่นๆ ความผิดปกติของระบบภูมิคุ้มกัน- เมื่อใช้การทดสอบนี้ แพทย์สามารถกำหนดระดับความเสี่ยงในการเกิดโรคของทารกในครรภ์ได้ และดำเนินมาตรการที่ทันท่วงทีเพื่อกำจัดสิ่งเหล่านี้
อันตรายของความเสียหายต่อร่างกายนั้นอยู่ที่ความล้มเหลวของการทำงานของอวัยวะที่ไม่ใช่อวัยวะเฉพาะ แต่เป็นความล้มเหลวของระบบส่วนใหญ่ของร่างกาย โปรตีนที่มีฤทธิ์รุนแรงจะทำลายข้อต่อ ผิวหนัง หลอดเลือด และอื่นๆ อวัยวะภายใน- บ่อยขึ้น อาการที่คล้ายกันพบเฉพาะในผู้หญิง ตามสถิติ เก้าในสิบต้องทนทุกข์ทรมานจากการมีเพศสัมพันธ์ที่ยุติธรรม ซึ่งมีอายุระหว่าง 15 ถึง 25 ปี ข้อบกพร่องทางพันธุกรรมนี้นำไปสู่การค่อยเป็นค่อยไป การเสื่อมสภาพทั่วไปสถานะสุขภาพ ประสบการณ์ของผู้ป่วย:
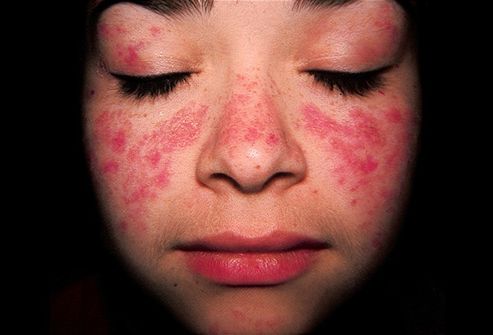
พยาธิวิทยาต้องมีการตรวจสอบอย่างต่อเนื่องจาก บุคลากรทางการแพทย์- ผลการรักษาของเธอโดยตรงขึ้นอยู่กับการละเลยกระบวนการทางพยาธิวิทยา ก่อนหน้านี้ผู้ป่วยสมัคร ความช่วยเหลือที่มีคุณสมบัติเหมาะสมยิ่งมีโอกาสบรรลุการบรรเทาอาการได้อย่างมั่นคงมากขึ้นเท่านั้น
โรคนี้มักนำพามาเสมอ ธรรมชาติเรื้อรังหลักสูตรนี้มีลักษณะเป็นช่วงเวลาของการกำเริบและการทุเลา สิ่งนี้สะท้อนให้เห็นอย่างชัดเจนในความเข้มข้นของโปรตีนเชิงรุก ตัวเลขสูงจะยืนยันกิจกรรมของกระบวนการทางพยาธิวิทยาและการลดลงของ titer บ่งบอกถึงการเริ่มมีอาการขับกล่อมชั่วคราว แม้ว่าในการแพทย์รัสเซียจะเป็นธรรมเนียมที่จะต้องแยกแยะโรค SLE เป็นแบบเฉียบพลันและ ประเภทเรื้อรังการศึกษาจากต่างประเทศพิสูจน์ว่าโรคนี้ยังคงรักษาไม่หายในปัจจุบัน
บ่งชี้ในการใช้และวัตถุประสงค์ของการศึกษา
- การปรากฏตัวของอาการทางคลินิกของโรคลูปัส:
- ลักษณะสีแดงของผิวหนังบนไหล่และใบหน้า
- ความเจ็บปวดในข้อต่อส่วนปลาย
- สัญญาณของภาวะไตวาย
- การโจมตีของโรคลมบ้าหมู
- การตรวจหาแอนติบอดีต่อต้านนิวเคลียร์ในการตรวจเลือด
- เพื่อควบคุม ไม่มีอาการโรคต่างๆ
วัตถุประสงค์หลักในการตรวจหาแอนติบอดีต่อ DNA ที่มีเกลียวคู่คือการวินิจฉัยแยกโรค แพร่กระจายโรคอีกประเภทหนึ่ง พร้อมทั้งประเมินประสิทธิผลของการรักษา
เช่นเดียวกับโรคอื่นๆ โรคลูปัสต้องได้รับความเอาใจใส่และการรักษาอย่างเป็นระบบ และถึงแม้ว่าพยาธิสภาพจะค่อนข้างร้ายแรงด้วย มีหลายรอยโรค ระบบภายในร่างกายก็ค่อนข้างจะสู้ได้ การวินิจฉัยอย่างทันท่วงทีโดยใช้การวิเคราะห์การมีอยู่ของ anti-dsDNA ช่วยให้คุณสามารถติดตามการพัฒนาได้ อาการทางพยาธิวิทยาและมีความสามารถและทันเวลา การรักษาทางการแพทย์,ผู้ป่วยสามารถนำ ชีวิตที่สมบูรณ์- สิ่งสำคัญคือการเชื่อและปฏิบัติตามคำแนะนำทั้งหมดของแพทย์ของคุณอย่างไม่มีเงื่อนไข
คำอธิบาย
โรคภูมิต้านตนเองรูมาตอยด์มักเกี่ยวข้องกับการมีออโตแอนติบอดีต่อแอนติเจนนิวเคลียร์หรือไซโตพลาสซึมต่างๆ แอนติบอดีต่อต้านนิวเคลียร์ที่เรียกว่าเหล่านี้สามารถแบ่งออกเป็นสามกลุ่ม: 1. แอนติบอดีต่อต้านนิวเคลียร์ที่แท้จริง (ANA): แอนติบอดีต่อแอนติเจน dsDNA, ssDNA, ฮิสโตน, RNA นิวเคลียร์และ DNA 2. แอนติเจนนิวเคลียร์ที่สกัดได้: Sm (Smith), n-RNP, Scl 70 และ PM-1 3. แอนติเจนของไซโตพลาสซึม: SS-A (Ro), SS-B (La) และ Jo-1 (SS-A และ SS-B มีการแปลเป็นภาษาท้องถิ่นในไซโตพลาสซึมและนิวเคลียส โปรตีนที่สร้างภูมิคุ้มกันสามารถเกิดขึ้นได้หลายรูปแบบและยังจับกับโปรตีนอีกด้วย ต้นกำเนิดของไวรัส- พวกมันกระตุ้นการสังเคราะห์โพลีโคลนอลแอนติบอดีของคลาส IgG, IgM และ IgA มีการสังเกตความสัมพันธ์ระหว่างโรคเนื้อเยื่อเกี่ยวพันแบบผสมและ การติดเชื้อไวรัสไวรัสเอพสเตน-บาร์ ปริมาณของแอนติบอดีระดับ IgG มีความสัมพันธ์อย่างยิ่งกับกิจกรรมของโรค จนถึงปัจจุบัน แอนติเจนที่สร้างภูมิคุ้มกันบกพร่องที่ได้รับการศึกษามากที่สุด ได้แก่ DNA แบบเกลียวคู่ (dsDNA), DNA แบบเกลียวเดี่ยว (ssDNA), Sm (Smith), sn-RNP (อนุภาคไรโบนิวคลีโอโปรตีนนิวเคลียร์ขนาดเล็ก ) สารเชิงซ้อน RNP/Sm ซึ่งทำให้เสถียรโดยกรดไรโบนิวคลีอิก เช่นเดียวกับ SS-A (Ro) และ SS-B (La) Antigen Scl 70 โปรตีนที่มี mm.m. 70 kDa เกี่ยวข้องกับโรคหนังแข็ง ในโรคภูมิต้านตนเองรูมาตอยด์ สามารถตรวจพบโปรไฟล์ที่แตกต่างกันของแอนติบอดีต่อแอนติเจนเหล่านี้ได้ กับ ความน่าจะเป็นสูงอาจเกี่ยวข้องกับการเกิดผื่นแดงทั้งระบบที่ทำงานหรือไม่ใช้งาน, โรคเนื้อเยื่อเกี่ยวพันแบบผสม (MCTD) (กลุ่มอาการของ Sharpe), โรคข้ออักเสบรูมาตอยด์ (RA), กลุ่มอาการของSjögren, โรคหนังแข็ง, โรคผิวหนังอักเสบจากแสง (PD) และโรคลูปัสที่เกิดจากยา (LU) โดยปกติแล้ว Anti-dsDNA สามารถตรวจพบได้ในผู้ป่วยที่เป็นโรค systemic lupus erythematosus (SLE) ในผู้ป่วยที่ไม่มีแอนติบอดีเหล่านี้ แอนติบอดีต่อต้าน ssDNA, ต่อต้าน SS-A และต่อต้าน SS-B เป็นเรื่องปกติมาก มีความสัมพันธ์ที่ชัดเจนระหว่างความเข้มข้นของแอนติบอดีและความรุนแรงของโรค โดยมีความเข้มข้นของแอนติบอดีเพิ่มขึ้น เวทีที่ใช้งานอยู่- แอนติบอดี บางประเภทไม่ได้จำเพาะเจาะจงกับโรคใดโรคหนึ่งเท่านั้น แต่สามารถเกิดได้หลายโรครวมกัน คุณสมบัติของการค้นหาการรวมกันของแอนติบอดีต่างๆ และความเข้มข้นพร้อมกับผลรวมทั้งหมด ภาพทางคลินิกผู้ป่วย - สำคัญ เครื่องมือวินิจฉัยในการประเมินโรคภูมิต้านตนเองรูมาตอยด์ แอนติบอดีต่อส่วนประกอบ SS-A และ SS-B มีอยู่ใน 40-80% ของผู้ป่วยที่มีอาการ Sjögren's หลักและ 30-50% ของผู้ป่วย SLE ในคนไข้ที่เป็นโรคSjögren แอนติบอดีต่อ SS-A และ SS-B มักเกิดขึ้นร่วมกัน เนื่องจากความสัมพันธ์ที่แข็งแกร่งของแอนติบอดี SS-A และ SS-B กับฟีโนไทป์ HLA-DR3 และ DR2 ความบกพร่องทางพันธุกรรม- Sjögren's syndrome เป็นโรคแพ้ภูมิตัวเองเรื้อรังที่ส่งผลต่อน้ำลายและ ต่อมน้ำตาซึ่งนำไปสู่ภาวะซีโรสโตเมียและซีโรโทเมีย การตรวจหาแอนติบอดีต่อ SS-A และ SS-B ในผู้ป่วยที่เป็นโรค Sjogren สามารถทำนายการพัฒนาของอาการภายนอกของโรคเช่น vasculitis, lymphadenopathy, ม้ามโต, โรคโลหิตจางและเม็ดเลือดขาว แอนติบอดีต่อ SS-A มักพบในประชากรผู้ป่วยโรค SLE ที่มีอาการไวแสงรุนแรง อาการทางผิวหนัง- ใน SLE พร้อมด้วยการปรากฏตัวของแอนติบอดีต่อ Ro/SS-A, ไตอักเสบจะพบได้น้อยกว่าในผู้ป่วยที่มีระดับแอนติบอดีต่อ dsDNA สูง แต่มีความเสี่ยงในการเกิดรอยโรคที่ผิวหนังและมีแนวโน้มที่จะเพิ่มความไวแสง คุ้มค่ามากได้ระบุแอนติบอดีต่อส่วนประกอบ SS-A ในสตรีระหว่างตั้งครรภ์ว่าเป็นปัจจัยเสี่ยงต่อการพัฒนาโรคหัวใจขั้นรุนแรงในทารกในครรภ์ แอนติบอดีต่อ SS-A พบได้ใน 98% ของมารดาที่ลูกป่วยเป็นโรคลูปัสในทารกแรกเกิด โรคนี้เกิดจากการแทรกซึมของแอนติบอดีต่อ SS-A เข้าสู่กระแสเลือดของทารกแรกเกิดผ่านทางรก อาการหลักของโรคลูปัสที่มีมา แต่กำเนิดคือโรคผิวหนังอักเสบและมีหลายระบบและ กลุ่มอาการทางโลหิตวิทยารวมถึงบล็อกขวางแต่กำเนิด, โรคตับอักเสบ, โรคโลหิตจาง hemolyticและภาวะเกล็ดเลือดต่ำ ประมาณครึ่งหนึ่งของมารดาที่มีลูกเป็นโรคลูปัสแต่กำเนิดมักไม่มีอาการใดๆ ก่อนคลอดบุตร หลังคลอด มารดาที่ไม่มีอาการส่วนใหญ่จะเห็นภาพของโรคเนื้อเยื่อเกี่ยวพันอย่างใดอย่างหนึ่ง หญิงตั้งครรภ์ทุกคนที่สงสัยว่าเป็นโรคเนื้อเยื่อเกี่ยวพันแบบผสมควรได้รับการตรวจทางภูมิคุ้มกันเพื่อระบุผู้ที่มีความเสี่ยงต่อโรคลูปัสแต่กำเนิดในทารกในครรภ์
แอนติบอดีต่อ ss-DNA ถูกตรวจพบใน systemic lupus erythematosus ในผู้ป่วย 80% ในระยะแสดงอาการของโรค และประมาณ 40% ของ SLE ที่ไม่ได้ใช้งาน อย่างไรก็ตาม แอนติบอดีต่อ DNA สายเดี่ยวไม่ได้จำเพาะต่อโรค SLE และพบได้ใน โรคข้ออักเสบรูมาตอยด์(มากถึง 35% ของกรณีทั้งหมด), โรคลูปัส erythematosus ที่เกิดจากยา, มะเร็งเม็ดเลือดขาว, โรคตับอักเสบ และ mononucleosis
แอนติบอดีเหล่านี้สามารถตรวจพบได้ใน scleroderma (มากถึง 50% ของกรณี) ใน 4% ของกรณี ตรวจพบแอนติบอดีต่อ ss-DNA ในคนที่มีสุขภาพดี แถว กระบวนการทางพยาธิวิทยาพร้อมด้วยการทำลายเนื้อเยื่อและการอักเสบเกิดขึ้นพร้อมกับการปรากฏตัวของแอนติบอดีประเภทนี้ (โรคตับอักเสบเรื้อรังภูมิต้านตนเอง, มะเร็งเม็ดเลือดขาวชนิดไมอีลอยด์เฉียบพลัน, มะเร็งเม็ดเลือดขาวชนิดลิมโฟไซติก)
Anti-dsDNA (anti-DNA) หรือแอนติบอดี DNA แบบเกลียวคู่อยู่ในกลุ่มแอนติบอดีที่ต่างกันกับ DNA แบบเกลียวคู่ และยังเป็นเครื่องหมายในห้องปฏิบัติการสำหรับ SLE (systemic lupus erythematosus)
แอนติบอดีต่อ DNA ซึ่งตั้งอยู่ภายในนิวเคลียสเรียกว่าแอนติบอดีต่อ DNA ที่มีเกลียวคู่ สาเหตุที่แน่ชัดของการปรากฏตัวในเลือดยังไม่ได้รับการพิสูจน์แล้ว
แอนติบอดีคืออะไร?
มีหลายกรณีที่การตอบสนองของระบบภูมิคุ้มกันมุ่งเป้าไปที่เนื้อเยื่อและเซลล์ของตัวเอง ไม่ใช่สิ่งแปลกปลอม แล้วมีการพัฒนา โรคแพ้ภูมิตัวเองและแอนติบอดีที่ผลิตต่อเซลล์ของตนเองและส่วนประกอบต่างๆ ของพวกมันเรียกว่าภูมิต้านตนเองโดยผู้เชี่ยวชาญ
หากระบบภูมิคุ้มกัน "พังทลาย" อย่างร้ายแรง ระดับของออโตแอนติบอดีจะเพิ่มขึ้น ซึ่งเพียงพอที่จะวินิจฉัยผู้ป่วยได้
แอนติบอดีต่อ DNA ที่มีเกลียวคู่ไม่ใช่แอนติบอดีตัวเดียว แต่เป็นสิ่งที่ซับซ้อนทั้งหมดโดยเป้าหมายคือ DNA ของนิวเคลียสของเซลล์
การทดสอบแอนติบอดีจะมีความไวสูงเมื่อ การวินิจฉัยโรคเอสแอลอีนั่นคือเมื่อ ผลลัพธ์ที่เป็นบวกเราสามารถพูดคุยเกี่ยวกับการยืนยันการวินิจฉัยได้ ใน 70-80% ของกรณี ผู้ป่วยจะถูกระบุโดยการวิเคราะห์นี้ อย่างไรก็ตาม เนื่องจากขาดความละเอียดอ่อนของการศึกษา จึงจำเป็นต้องมีความระมัดระวังเป็นอย่างยิ่งในการอ่านผลการทดสอบ เนื่องจากหากผลลัพธ์เป็นลบ ก็ถือว่าผู้ป่วยไม่มีโรค SLE เลย
การทดสอบเหล่านี้มักกำหนดโดยแพทย์โรคไขข้อ แต่การส่งตัวต่อสามารถออกได้โดยนักบำบัด นักไตวิทยา และแพทย์ผิวหนัง ทุกอย่างจะขึ้นอยู่กับผู้เชี่ยวชาญที่ผู้ป่วยปรึกษาในตอนแรก ห้องปฏิบัติการภูมิคุ้มกันวิทยาเป็นสถานที่ที่ใช้ทดสอบแอนติบอดี การฝึกอบรมพิเศษไม่จำเป็นสำหรับการวิเคราะห์
SLE - โรคลูปัส erythematosus ระบบ
SLE เป็นโรคแพ้ภูมิตัวเองอย่างรุนแรงซึ่งส่งผลกระทบต่อระบบและอวัยวะต่างๆ พร้อมกัน (สมอง ผิวหนัง ไต ข้อต่อ ระบบหลอดเลือด และหัวใจ) ไม่จำเป็นต้องมีอาการในอวัยวะทุกส่วนพร้อมกัน อาการของโรคลูปัสค่อนข้างหลากหลาย: ในคนคนหนึ่งอาการจะเด่นกว่า อาการทางผิวหนังในอีกตัวอย่างหนึ่ง - ไต
แอนติบอดีต่อ DNA ที่มีเกลียวคู่ตามธรรมชาติจะช่วยระบุโรคนี้ได้
ปัจจัยเสี่ยงในการเกิดโรคลูปัส erythematosus แบบเป็นระบบ
- การเปลี่ยนแปลง ระดับฮอร์โมน(การคลอดบุตร การตั้งครรภ์ การมีประจำเดือน) ซึ่งทำให้เกิดโปรแลคตินและเอสโตรเจนซึ่งอธิบายความถี่ของโรคสูง 90% ในกลุ่มประชากรสตรี
- จูงใจที่จะ ระดับพันธุกรรมซึ่งได้รับการยืนยันจากญาติของผู้ป่วยโรค SLE ระดับต่ำแอนติเจนของระบบ HLA และออโตแอนติบอดีบางชนิด
- ยา - "Methyldopa", "Procainamide", "Hydralazine"
- การติดเชื้อไวรัสที่กระตุ้นให้เกิดกระบวนการภูมิต้านตนเอง
- การฉายรังสีจากแสงอาทิตย์ (รังสีอัลตราไวโอเลตทำให้เซลล์ผิวหนังตายแบบอะพอพโทส เปิดเผย DNA และระบบภูมิคุ้มกันจะมองเห็นได้)
สำหรับ DNA ที่มีเกลียวคู่นั้นให้ข้อมูลได้ดีมาก
อาการของโรคเอสแอลอี
สัญญาณที่พบบ่อยของอาการ ได้แก่ ต่อมน้ำเหลืองโต เหนื่อยล้าและอ่อนแรง อุณหภูมิร่างกายเพิ่มขึ้น น้ำหนักลด ปวดข้อและกล้ามเนื้อ
- หรือไตถูกทำลาย (การทำงานของไตลดลงและมีอาการทางห้องปฏิบัติการสามอาการ)
- ปวดข้อและโรคข้ออักเสบ ทำให้เกิดการอักเสบและ ความรู้สึกเจ็บปวดในข้อต่อของข้อมือ, มือ, เอ็กซ์เรย์โดยจะแสดงความหนาแน่นของกระดูกบริเวณข้อ (periarticular osteoporosis) ลดลง แต่จะไม่เกิดการพังทลาย
- Serositis นั่นคือการอักเสบ เมมเบรนเซรุ่มปอดและหัวใจ (เยื่อหุ้มปอดอักเสบ, เยื่อหุ้มหัวใจอักเสบ)
- ความไวแสงทำให้อาการแย่ลงเมื่อถูกแสงแดด
- ผื่นรวมทั้งบนใบหน้า ผื่นผีเสื้อ แอนติบอดีต่อ DNA สายคู่จะถูกตรวจพบอย่างแน่นอน
- โรคไตอักเสบ - 45-65%
- Microhematuria คือการมีเซลล์เม็ดเลือดแดง 80% ในตะกอนปัสสาวะ
- ภาวะโปรตีนในปัสสาวะสัมพันธ์กับการสูญเสียโปรตีนในปัสสาวะในปริมาณมากกว่า 0.5 กรัมต่อวินาที นั่นคือ 100%
- เป็นเรื่องยากมากที่เม็ดเลือดขาวจำนวนมากจะปรากฏในปัสสาวะ (pyuria) โดยเฉพาะอย่างยิ่งในกรณีที่ไม่มีการติดเชื้อทางเดินปัสสาวะ

หากตรวจพบแอนติบอดีต่อ DNA สายคู่ในผู้ป่วยโรค SLE จำเป็นต้องมีการตรวจติดตามซ้ำหลังจากผ่านไป 1-3-6-12 เดือน ขึ้นอยู่กับความรุนแรงของโรค ผู้ป่วยเหล่านี้มีความเสี่ยงเพิ่มขึ้นที่จะเกิดความเสียหายต่อไต เนื่องจากสารเชิงซ้อนของ antiDNA ที่มีสารเชิงซ้อนภูมิคุ้มกันทำให้เกิดความเสียหายต่อไต
การวิเคราะห์ต่อต้าน DNA
การวิเคราะห์นี้จำเป็น:
- เพื่อทำนายผลสำเร็จของการรักษา
- เมื่อสงสัยว่าเป็นโรคแพ้ภูมิตัวเองแบบเป็นระบบ
- เมื่อผลลัพธ์ของแอนติบอดี ENA เป็นบวก การทดสอบแอนติบอดีต่อแอนติบอดีก็จะเป็นบวก
- เมื่อมีอาการ SLE
- เมื่อสงสัยว่าเป็นโรคทางระบบโดยเฉพาะโรค SLE
- สำหรับ การวินิจฉัยแยกโรคโรคข้อ
- เมื่อผลการทดสอบแอนติบอดีต่อต้านนิวเคลียร์เป็นบวก
- เพื่อทำนายการพัฒนาของความเสียหายของไต
- เพื่อควบคุมการไหลของ SCR
จะเกิดอะไรขึ้นกับคนๆ หนึ่งเมื่อเขายกระดับแอนติบอดีให้เป็น DNA แบบเกลียวคู่?
อาการของการตรวจหา antiDNA

แอนติบอดีต่อ DNA ที่มีเกลียวคู่: ปกติ
โดยปกติผลการทดสอบควรเป็นลบ และความเข้มข้นควรอยู่ระหว่าง 0-25 IU/ml
หากผลเป็นบวก เราสามารถพูดคุยเกี่ยวกับ: โรคตับแข็งทางเดินน้ำดีปฐมภูมิ; โรคเอสแอลอี; mononucleosis ที่ติดเชื้อ- ประสิทธิผลของการรักษา (SLE ในการบรรเทาอาการ); โรคตับอักเสบเรื้อรังซี และ บี; กลุ่มอาการของโจเกรน; โรคผสมเนื้อเยื่อเกี่ยวพัน
DNA และแอนติบอดีที่มีเกลียวคู่ (IgG และ IgM immunoglobulins) ก่อให้เกิดภูมิคุ้มกันที่ซับซ้อน ทำให้เกิดอาการบางอย่างที่มีลักษณะเฉพาะของโรค SLE
ถ้าผลเป็นลบก็บอกว่า โรคลูปัสที่เกิดจากยาหรือการไม่มี SLE
อะไรมีอิทธิพลต่อผลลัพธ์ของการวิเคราะห์?
- ระดับ antiDNA ที่สูงสัมพันธ์กับโรคไตอักเสบลูปัส การกำเริบของโรค หรือความล้มเหลวในการควบคุมโรค
- ระดับ antiDNA ต่ำมีความสัมพันธ์กับประสิทธิผลของการรักษาและความสำเร็จในการบรรเทาอาการของโรค
- AntiDNA เป็นตัวบ่งชี้เฉพาะของโรค SLE แต่ก็สามารถสังเกตได้ในโรคอื่นๆ ด้วย (แพ้ภูมิตัวเอง โรคตับอักเสบซีเรื้อรัง และบี)
- หากไม่มี antiDNA ก็จะไม่รวมการวินิจฉัยโรค SLE
- การตรวจหา antiDNA ในผู้ป่วยที่ไม่มีอาการหรือเกณฑ์อื่นใดสำหรับโรคนี้ไม่ได้ถูกตีความเพื่อวินิจฉัยโรค SLE
หมายเหตุสำคัญ
การตรวจเลือดเพื่อหาแอนติบอดีต่อ DNA ที่มีเกลียวคู่ดำเนินการร่วมกับการศึกษาต่อไปนี้:

- แอนติบอดีต่อต้าน SSB และต่อต้าน SSA;
- แอนติบอดีต้าน SCL-70;
- แอนติบอดีต่อต้าน nRNP;
- แอนติบอดีต่อต้าน Sm;
- แอนติบอดีต่อต้าน sp100
ข้อเท็จจริงสองประการเกี่ยวกับ antiDNA
นอกจากนี้ antiDNA ยังปรากฏในเลือดเนื่องจากสาเหตุดังต่อไปนี้:
ดังนั้นจึงมีการใช้เลือดบ่อยครั้งเพื่อตรวจหาแอนติบอดีต่อ DNA ที่มีเกลียวคู่






